CIRUGÍA DE LA EPILEPSIA
Concepto
La cirugía de la epilepsia se entiende como la cirugía dirigida a eliminar o disminuir la frecuencia o gravedad de las CE. Para ello, hay que resecar o desconectar la zona epileptógena (aquella cuya resección o desconexión es necesaria y suficiente para que desaparezcan las CE), sin producir déficits al paciente. En el caso de que no sea posible una cirugía resectiva, se recurrirá a procedimientos de cirugía paliativa o a sistemas de neuroestimulación29,30. Se ha demostrado de forma consistente que, en pacientes bien seleccionados, la cirugía de epilepsia en un procedimiento con un buen coste-efectividad31,32.
Indicaciones del tratamiento quirúrgico
El planteamiento del tratamiento quirúrgico se debe realizar basándose en dos aspectos:
- El paciente debe presentar una epilepsia farmacorresistente1:
- Presencia de CE que interfieren en la vida diaria del paciente. Se ha de valorar también la interferencia producida por los efectos secundarios derivados de la medicación anticrisis, especialmente en el caso de los niños33.
- Las CE persisten tras la utilización adecuada de al menos dos FAC, en monoterapia o en combinación. Ver capítulo 5.1.
- Evolución durante un periodo de tiempo razonable, probablemente de al menos dos años. En el caso de epilepsia que pueda amenazar la vida y en el caso de niños el periodo puede ser menor de dos años.
- Epilepsia tratable quirúrgicamente:
- El paciente presenta uno de los “síndromes remediables quirúrgicamente”
(definidos por historia natural conocida, evaluación prequirúrgica no invasiva, habitualmente mal control farmacológico y buenos resultados con cirugía), en cuyo caso se puede plantear una cirugía más precoz.
- La evaluación prequirúrgica muestra que la cirugía puede mejorar la epilepsia del paciente con secuelas aceptables, teniendo en cuenta la situación basal y la gravedad de las CE.
Contraindicaciones del tratamiento quirúrgico
Las contraindicaciones potenciales a la cirugía habrán de valorarse e individualizarse en función del paciente. Se habrá de considerar:
- Edad: no existe contraindicación formal y se habrá de valorar especialmente la relación beneficio/riesgo en pacientes de edad avanzada.
- Causa de la epilepsia: no son candidatos aquellos pacientes en los que la etiología de la epilepsia es una enfermedad neurológica progresiva, excepto en el caso de la encefalitis de Rasmussen.
- Enfermedades médicas concomitantes: pueden contraindicar la cirugía si comprometen el pronóstico vital o funcional.
- Enfermedades psiquiátricas concomitantes: contraindican la cirugía únicamente si pueden comprometer el resultado de la cirugía o el seguimiento posterior.
- Coeficiente intelectual (CI): un CI inferior a 70, que se ha identificado como un factor de peor pronóstico en el control de CE tras cirugía resectiva, pero no se considera una contraindicación para ello.
Epidemiología
Entre un 30-40 % de las personas con epilepsia continúan teniendo CE a pesar del tratamiento farmacológico. Dichos pacientes serán subsidiarios de evaluación prequirúrgica y deber ser remitidos a una unidad especializada en epilepsia refractaria que tenga formación y experiencia en cirugía de la epilepsia. Alrededor del 5 % de los pacientes con epilepsia podrían beneficiarse del tratamiento quirúrgico34.
Selección del candidato quirúrgico
La cirugía de la epilepsia actual requiere de un equipo multidisciplinario de especialistas con una formación específica en la materia, de su colaboración en una misma unidad, y de los medios tecnológicos necesarios (tabla VI)35.
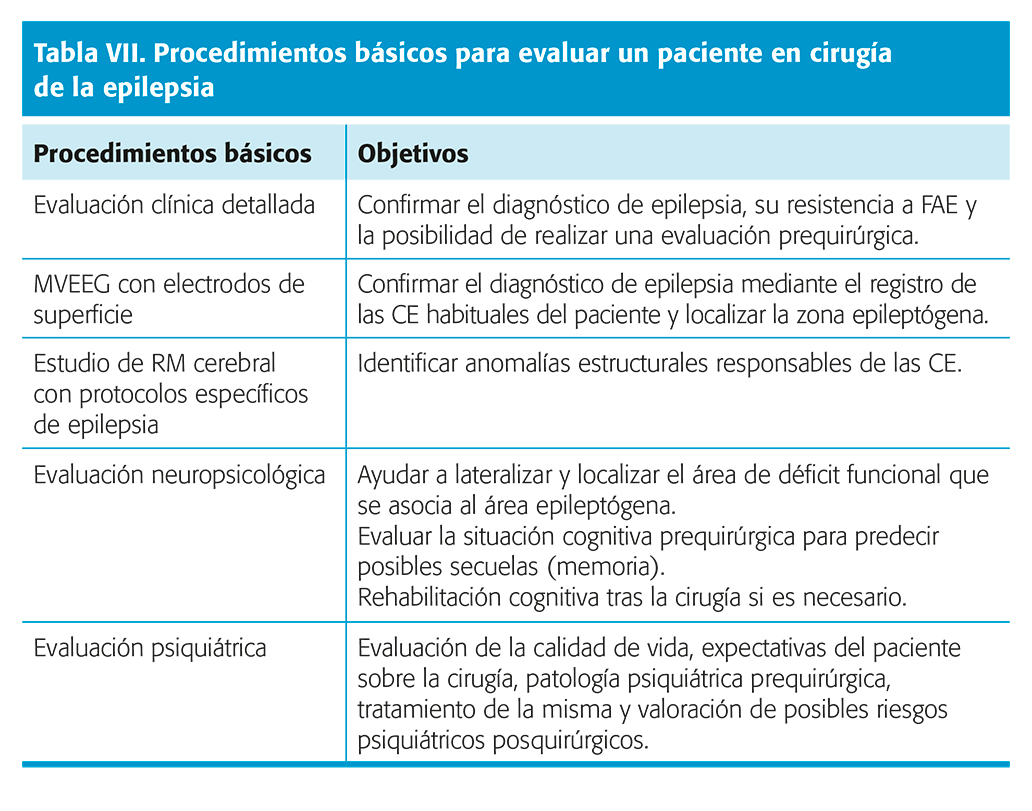
No hay un acuerdo unánime acerca de qué tipo y cantidad de información se debe obtener antes de indicar un tipo concreto de intervención quirúrgica, de entre las distintas opciones empleadas. La evaluación prequirúrgica de los pacientes comprenderá estudios encaminados a identificar la localización y extensión de la zona epileptógena y a valorar el posible impacto de la cirugía sobre las funciones neurológicas, cognitivas y estado emocional del paciente36.
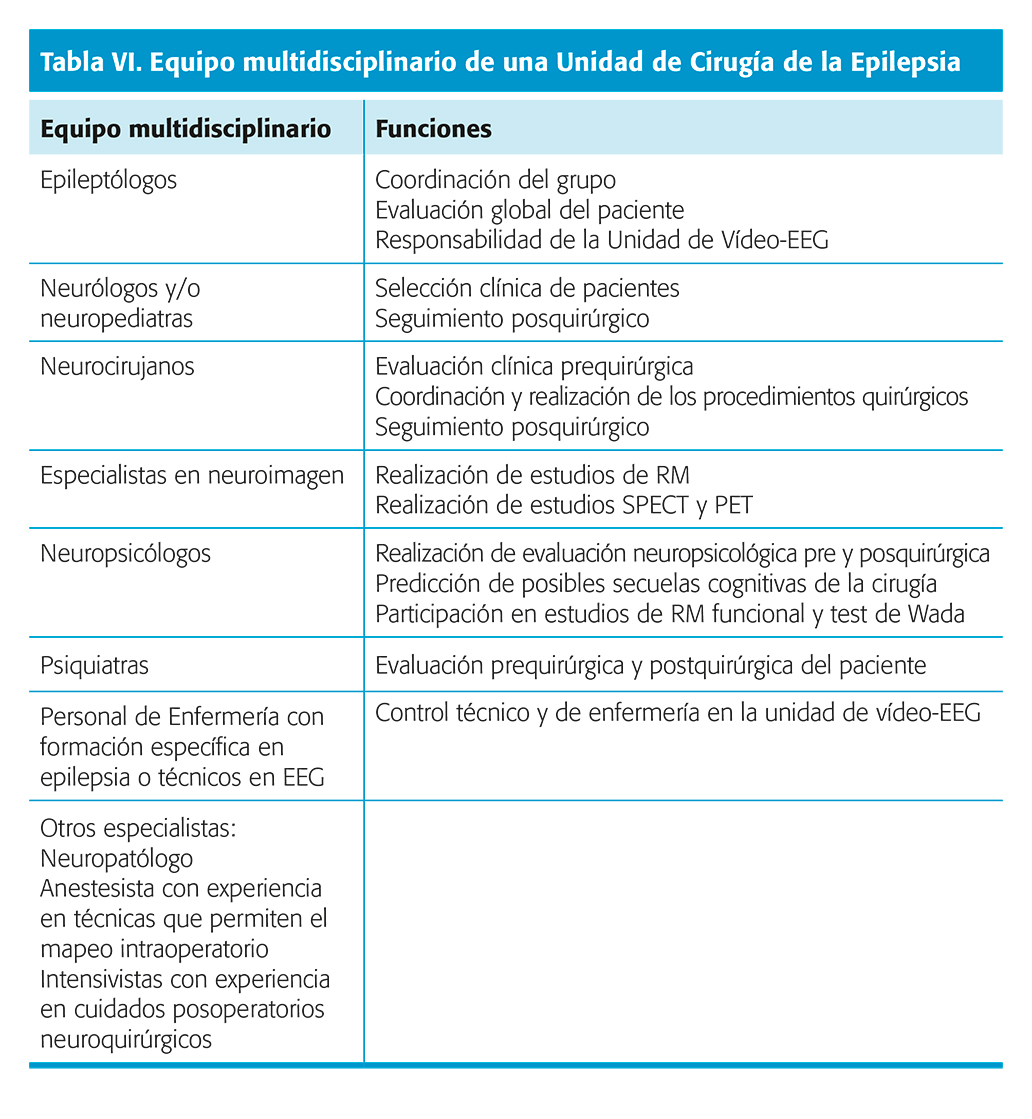
Como norma general, se realizarán una serie de procedimientos básicos previos a la indicación quirúrgica en todos los pacientes, y posteriormente, si es necesario, se realizarán otros más específicos (tablas VII y VIII).
Es deseable que la decisión final del tratamiento quirúrgico se tome en una sesión multidisciplinar con todos los miembros del equipo.
Epilepsias tratables mediante cirugía
Epilepsias tratables mediante técnicas resectivas o de desconexión
Cirugía curativa. El objetivo es la desaparición de las CE.
Síndromes tratables quirúrgicamente:
- Epilepsia del lóbulo temporal medial secundaria a esclerosis del hipocampo. La frecuencia de este síndrome parece haber disminuido en los últimos años, como demuestran el menor número de derivaciones para cirugía temporal tanto en Europa como en EEUU37.
La intervención indicada es la amigdalohipocampectomía, generalmente acompañada de una lobectomía temporal anterior. Hasta dos tercios de los pacientes suelen quedar libres de CE. En el único estudio aleatorizado, semicontrolado realizado en pacientes con epilepsia temporal cuyas CE no se controlaban adecuadamente con FAC, la lobectomía temporal anterior y tratamiento posterior con fármacos fue superior al tratamiento médico para suprimir las CE38,39. Nivel de evidencia I. No parecen existir diferencias en el resultado de la cirugía cuando se compara la lobectomía temporal anterior con la amigdalohipocampectomía selectiva, pues no hay estudios aleatorizados que comparen ambos procedimientos. No obstante, sí se ha observado en un ensayo clínico aleatorizado, que la resección completa del hipocampo se asocia a una mejor respuesta en el control de CE que la resección parcial, sin objetivarse un peor rendimiento neuropsicológico postquirúrgico40. Nivel de evidencia II. Tampoco se han descrito diferencias entre el abordaje subtemporal o transilvano en el caso de la amigdalohipocampectomía selectiva41. Se ha observado que no existen diferencias en cuando a la nominación ni en cuanto al resultado de la cirugía con respecto a la resección o no del girus temporal superior42. Nivel de evidencia II. Tampoco se han encontrado diferencias entre resecar 2,5 cm o 3,5 cm en la lobectomía temporal anterior34.
hay estudios aleatorizados que comparen ambos procedimientos. No obstante, sí se ha observado en un ensayo clínico aleatorizado, que la resección completa del hipocampo se asocia a una mejor respuesta en el control de CE que la resección parcial, sin objetivarse un peor rendimiento neuropsicológico postquirúrgico40. Nivel de evidencia II. Tampoco se han descrito diferencias entre el abordaje subtemporal o transilvano en el caso de la amigdalohipocampectomía selectiva41. Se ha observado que no existen diferencias en cuando a la nominación ni en cuanto al resultado de la cirugía con respecto a la resección o no del girus temporal superior42. Nivel de evidencia II. Tampoco se han encontrado diferencias entre resecar 2,5 cm o 3,5 cm en la lobectomía temporal anterior34.
Los pacientes son remitidos tarde para valoración quirúrgica. Se ha visto en un reciente estudio que la cirugía precoz es más eficaz que los FAC en pacientes con ER36. Nivel de evidencia II. Un análisis de decisión que utilizó datos publicados sobre frecuencia de CE y calidad de vida mostró que la resección en pacientes con epilepsia del lóbulo temporal farmacorresistente proporciona mejoras sustanciales en la esperanza de vida a los 5 años comparado con el tratamiento médico44.
- Epilepsias neocorticales con lesión única circunscrita.
La intervención indicada es la lesionectomía. La RM suele ser suficiente para guiar la cirugía y lo habitual es que la zona epileptógena se sitúe en proximidad inmediata a la lesión estructural. Los estudios invasivos pueden ser necesarios para definir los límites de la zona epileptógena, especialmente si se halla en la proximidad de zonas elocuentes.
Los porcentajes de pacientes libres de CE en series lesionales a nivel temporal son similares a los de la epilepsia del lóbulo temporal medial secundaria a esclerosis del hipocampo y ligeramente inferiores en las lesionectomías extratemporales45. Se puede ofrecer tratamiento quirúrgico de una lesión epileptogénica con el propósito de obtener una mejora cognitiva en situaciones específicas como un estatus de punta onda durante el sueño, cuando hay deterioro cognitivo asociado46.
- Síndromes de epilepsia hemisféricos.
Destacan la hemimegalencefalia, el síndrome de Sturge-Weber, el síndrome de Rasmussen, las lesiones isquémicas congénitas unilaterales, la hemi-polimicrogiria y otras epilepsias catastróficas unilaterales en las que estaría indicada una técnica de desconexión en alguna de sus variedades (hemisferectomía funcional o hemisferectomía)47. Nivel de evidencia III.
En estos pacientes, se debe valorar el riesgo de la cirugía frente a los efectos devastadores de las crisis continuadas y las posibles mejoras cognitivas postoperatorias en pacientes que quedan libres de CE.
Los resultados son buenos y hasta un 60-80 % de los pacientes quedan libres de CE dependiendo de la patología subyacente, aunque las secuelas son hemiparesia y hemianopsia, que pueden mejorar parcialmente con el tiempo36. Salvo raras excepciones, esta intervención quirúrgica se realiza únicamente en pacientes con hemiparesia preexistente y sin función útil de la mano contralateral al hemisferio afectado.
Otros síndromes tratables quirúrgicamente con peores resultados
Están basados en opiniones de grupos de expertos. Nivel de evidencia IV.
- Epilepsias neocorticales sin lesión única circunscrita. En pacientes con patología dual, lesiones mal definidas o poco circunscritas puede plantearse la cirugía resectiva48, en la mayoría de los casos, previo estudio con electrodos invasivos49. El pronóstico es peor en epilepsia extratemporal48.
- Epilepsias neocorticales no lesionales. Este tipo de epilepsias representan un importante reto y, a menudo, requieren estudios con electrodos invasivos. Si la epilepsia es temporal, los pacientes libres de crisis pueden alcanzar el 60 %50, reduciéndose al 35 % si el origen es extratemporal51.
- Epilepsias neocorticales no lesionales con claros signos lateralizadores52: Estos signos se basan en los hallazgos EEG interictales, ictales o la semiología ictal. En este grupo encontramos de forma frecuente las epilepsias frontales.
El estudio mediante electrodos invasivos, fundamentalmente mediante estereoelectroencefalografía (E-EEG) suele ser de elección frente a otros tipos de estudios invasivos, dado que las zonas a explorar suelen ser muy extensas.
- Epilepsias neocorticales no lesionales sin claros signos lateralizadores49,52: Éste es un punto muy controvertido; no obstante, los avances en técnicas como la E-EEG, realizados en centros de referencia, permiten en algunas ocasiones valorar a estos pacientes mediante implantación bilateral de electrodos profundos para determinar la lateralidad e implementar los estudios mediante la implantación ulterior de electrodos
- Epilepsias
- Epilepsias generalizadas de origen genético52: Este tipo de epilepsias, también
conocidas como epilepsias generalizadas idiopáticas o generalizadas primarias, no suelen ser farmacorresistentes. Los raros casos refractarios suelen ser evaluados en profundidad, con el objetivo de descartar en todos los casos, la presencia de fenómenos semiológicos o electrográficos como la hipersincronía bilateral secundaria que sugieran una posible epilepsia de inicio focal potencialmente tratable con cirugía53.
- Epilepsias generalizadas tipo Lennox-Gastaut52: En estas epilepsias también conocidas como generalizadas sintomáticas o criptogénicas, la cirugía resectiva no es una opción, a no ser que exista una lesión visible en los estudios de imagen; pero otras alternativas como la callosotomía o la neuroestimulación mediante estimulador vagal (VNS) o la estimulación cerebral profunda (DBS) podrían
En la tabla IX vemos los datos de pronóstico en los distintos procedimientos quirúrgicos.
Cirugía paliativa. Procedimientos encaminados a buscar la mejoría en las CE.
- Resecciones subpiales múltiples: técnica prácticamente abandonada de desconexión, empleada en el caso de cirugía en áreas elocuentes. Se puede plantear su empleo en algunas entidades como el síndrome de Landau-Kleffner. Los resultados de las mejores series, con un seguimiento de 4 años, muestran un 55 % de pacientes libres de CE, con un 4 % de déficits permanentes36.
- Callosotomía: sección parcial o total del cuerpo calloso. Se puede plantear su empleo en pacientes que presenten CE con caídas, lográndose la mejoría en el 70 % de los intervenidos36.
Técnicas no resectivas (véase capítulo 5.3.)

CIRUGÍA DE EPILEPSIA Y ELECTRODOS INTRACRANEALES
La utilización de estudios mediante electrodos invasivos intracraneales no se recomienda en ausencia de una hipótesis razonable sobre la etiología de la epilepsia, la zona epileptógena (ZE) y su relación con el córtex elocuente54.
Tampoco se recomienda en los casos en los que la información que se espera obtener del estudio con invasivos pueda recogerse mediante la realización de otros tipos de estudios de carácter no invasivo54.
En los casos que se considere poco probable que el estudio con electrodos invasivos modifique de alguna manera el plan quirúrgico inicial, como puede ocurrir en el caso de los casos típicos de epilepsia y hamartoma hipotalámico o los síndromes hemisféricos, la utilización de electrodos invasivos no es de elección54.
Las indicaciones generales incluyen aquellos casos en los que los estudios no invasivos no arrojan información concluyente sobre la localización de la ZE o pueden existir dos o más zonas implicadas como es el caso de las lesiones bilaterales, muy extensas o múltiples. El mapeo del córtex elocuente o el tratamiento mediante termocoagulación pueden ser otras indicaciones de los estudios mediante electrodos invasivos54,55. Nivel de evidencia IV.
Electrocorticografía (ECoG)
Es el estudio EEG y mapeo mediante estimulación eléctrica de forma perioperatoria, a través de la craneotomía de forma previa y posterior a la resección. Se recomienda en casos de epilepsia del lóbulo temporal sin esclerosis mesial asociada con presencia de lesiones en neocórtex para determinar la extensión de la resección. En los casos en los que existe esclerosis mesial, podría ser de utilidad si existe patología dual54,56.
Esta técnica se utiliza, especialmente, en casos de displasia cortical, esclerosis tuberosa, malformaciones cavernomatosas o en los casos en los que se objetive actividad epileptiforme continua en los estudios de superficie54,56.
Estudios invasivos extraoperatorios con electrodos implantados mediante craneotomía abierta (C-EEG)54
En esta técnica se utilizan electrodos de tiras o mantas subdurales que se colocan a través de la craneotomía y se mantienen de forma extraoperatoria por un tiempo variable pero limitado.
Se recomienda su uso en los casos en los que la ZE sea neocortical, unilateral y muy extensa, y sea necesario el mapeo preciso de zonas elocuentes atípicas.
Estéreo-electroencefalografía (E-EEG)
Consiste en el registro intracraneal del EEG mediante la implantación de electrodos intracerebrales colocados mediante cirugía estereotáctica a través de trépano en el cráneo.
Se utiliza tanto en casos lesionales como no lesionales, en los que sea necesaria la exploración de zonas profundas como los fondos de surco, la región temporal mesial, la región opérculo-insular, en casos de polimicrogirias y heterotopias nodulares periventriculares o cuando sea necesaria una exploración bihemisférica55,57.
En los casos lesionales, debe considerarse especialmente, si existe una discordancia entre la localización de la lesión, el inicio ictal en superficie y la semiología ictal, cuando sea necesario determinar el rol de la lesión en la zona o red epileptógena o su relación con el córtex elocuente54,55,57.
Se considera el método de elección en los casos no lesionales o en pacientes con craneotomías previas55.
La E-EEG se realiza además en los casos en los que el tratamiento mediante termocoagulación se considere como opción terapéutica54,55.
En el caso concreto de los hamartomas hipotalámicos, existe controversia. No obstante, y en general, se considera que en los casos típicos donde no se sospeche la implicación de otras zonas anatómicas en la ZE, no es necesario el estudio mediante E-EEG54,55.
Estudios extraoperatorios mixtos o híbridos (HEEG)
Consiste en la implantación combinada de electrodos intracerebrales de profundidad (E-EEG) y electrodos subdurales (C-EEG).
Se recomienda, especialmente, en los casos en los que sea necesario determinar la localización de la ZE y para ello comparar zonas más superficiales y zonas profundas, en los casos en los que estén indicadas las exploraciones bihemisféricas extensas, en la valoración adicional de zonas remotas y en los casos en que sea necesario explorar zonas medio-posteriores de ambos lóbulos temporales54

Bibliografía
- Kwan P, Arzimanoglou A, Berg AT, Brodie MJ, Allen Hauser W, Mathern G, et al. Definition of drug resistant epilepsy: consensus proposal by the ad hoc Task Force of the ILAE Commission on Therapeutic Epilepsia 2010; 51:1069-77.
- Roberti R, Assenza G, Bisulli F, Boero G, Canafoglia L, Chiesa V, et al. Adjunctive cenobamate in people with focal onset seizures: Insights from the Italian Expanded Access Program. Epilepsia. 2024; 65: 2909-22.
- Laxer KD, Elder CJ, Di Gennaro G, Ferrari L, Krauss GL, Pellinen J, et al. Presurgical use of cenobamate for adult and pediatric patients referred for epilepsy surgery: expert panel recommendations. Neurol Ther. 2024; 13: 1337-48.
- Margolis JM, Chu BC, Wang ZJ, Copher R, Cavazos JE. Investigation off effectiveness of antiepileptic drug combination therapy for partial-onset seizures based on mechanisms of action. JAMA Neurol. 2014; 71: 985-93.
- Poolos NP, Castagna CE, Williams S, Miller AB, Story TJ. Association between antiepileptic drug dose and long-term response in patients with refractory epilepsy. Epilepsy Behav. 2017; 69: 59-68.
- Binnie CD, Polkey CE, International League Against Commissión on Neurosurgery of the International League Against Epilepsy (ILAE) 1993-1997: Recommended Standards. Epilepsia. 2000; 41: 1346-9.
- Pre-surgical evaluation for epilepsy surgery - European standards. European Federation of Neurological Societies Task Eur J Neurol. 2000; 7:119-22.
- Widjaja E, Li B, Schinkel CD, Puchalski Ritchie L, Weaver J, Snead OC, et Cost-effectiveness of pediatric epilepsy surgery compared to medical treatment in children with intractable epilespy, Epilepsy Res. 2011; 94: 61-8.
- Langfitt JT, Holloway RG, McDermott MP, Messing S, Sarosky K, Berg AT, et Health care costs decline after successful epilepsy surgery. Neurology. 2007; 68: 1290-8.
- Cross JH, Jayakar P, Nordli D, Delalande O, Duchowny M, Wieser HG, et al. International League against Epilepsy, Subcommission for Paediatric Epilepsy Surgery; Commissions of Neurosurgery and Paediatrics. Proposed criteria for referral and evaluation of children for epilepsy surgery: recommendations of the Subcommission for Pediatric Epilepsy Epilepsia. 2006; 47: 952-9.
- Rosenow F, Lüders Presurgical evaluation of epilepsy. Brain. 2001; 124: 1683-700.
- Gumnit RJ, Walczak National Association of Epilepsy Centers. Guidelines for essential services, personnel and facilities in specialized epilepsy centers in the United States. Epilepsia. 2001; 42: 804-14.
- Grupo de Cirugía Funcional de la Sociedad Española de Neurocirugía (SENEC). Guías clínicas para la cirugía de la Epilepsia y de los Trastornos del Neurocirugía. 2009; 20: 329-34.
- Van Gompel JJ, Ottman R, Worrell GA, Marsh R, Wetjen NM, Cascino GD, et Use of anterior temporal lobectomy for epilepsy in a community-based population. Arch Neurol. 2012; 69: 1476-81.
- Engel J Jr, Wiebe S, French J, Sperling M, Williamson P, Spencer D, et al. Practice parameter: Temporal lobe and localized neocortical resections for epilepsy: report of the Quality standards subcommittee of the American Academy of Neurology, in association with the American Epilepsy Society and the American Association of Neurological Neurology. 2003; 60: 538-47.
- Wiebe S, Blume WT, Girvin JP, Eliasziw M; Effectiveness and efficiency of surgery for temporal lobe epilepsy study group. A randomized, controlled trial of surgery for temporal lobe N Engl J Med. 2001; 345: 311-8.
- Wyler AR, Hermann BP, Somes G. Extent of medial temporal resection on outcome from anterior temporal lobectomy: a randomized prospective study. Neurosurgery. 1995; 37: 982-90.
- West S, Nevitt SJ, Cotton J, Gandhi S, Weston J, Sudan A, et Surgery for epilepsy. Cochrane Database Syst Rev. 2019; Jun 25: CD010541.
- Hermann B, Davies K, Foley K, Bell B. Visual confrontation naming outcome after standard left anterior temporal lobectomy with sparing versus resection of the superior temporal gyrus: a randomized prospective clinical Epilepsia. 1999; 40: 1070-6.
- Engel J, McDermott MP, Wiebe S, Langfitt JT, Stern JM, Dewar S, et al; for the early randomized surgical epilepsy trial (ERSET) study Early surgical therapy for drug-resistant temporal lobe epilepsy. A randomized trial. JAMA 2012; 307: 922-30.
- Choi H, Sell RL, Lenert L, Muennig P, Goodman RR, Gilliam FG, et al. Epilepsy surgery for pharmacoresistant temporal lobe epilepsy: a decision JAMA. 2008; 300: 2497-505.
- Devaux B, Chassoux F, Guenot M, Haegelen C, Bartolomei F, Rougier A, et al. Epilepsy surgery in Neurochirurgie. 2008; 54: 453-65.
- Loddenkemper T, Cosmo G, Kotagal P, Haut J, Klaas P, Gupta A, et al. Epilepsy surgery in children with electrical status epilepticus in Neurosurgery. 2009; 64: 328-37.
- Cook SW, Nguyen ST, Hu B, Yudovin S, Shields WD, Vinters HV, et al. Cerebral hemispherectomy in pediatric patients with epilepsy: comparison of three techniques by pathological substrate in 115 J Neurosurg. 2004; 100: 125-41.
- Téllez-Zenteno JF, Dhar R, Wiebe Long-term seizure outcomes following epilepsy surgery: a systematic review and meta-analysis. Brain. 2005; 128: 1188-98.
- Chassoux F, Navarro V, Catenoix H, Valton L, Vignal JP. Planning and management of Neurophysiol Clin. 2018; 48: 25-37.
- Bell ML, Rao S, So EL, Trenerry M, Kazemi N, Matt Stead S, et al. Epilepsy surgery outcomes in temporal lobe epilepsy with a normal Epilepsia. 2009; 50: 2053-60.
- Wetjen NM, Marsh WR, Meyer FB, Cascino GD, So E, Britton JW, et al. Intracranial electroencephalography seizure onset patterns and surgical outcomes in nonlesional extratemporal J Neurosurg. 2009; 110: 1147-52.
- Benbadis SR, Geller E, Ryvlin P, Schachter S, Wheless J, Doyle W, et al. Putting all together: options for intractable An update algorythm on the use of epilepsy surgery and neurostimulation. Epilepsy Behav. 2018; 88s: 33-8.
- Benbadis SR. Observations on the missdiagnosis of generalized epilepsy as partial epilepsy; causes and Seizure. 1999; 8:140-5.
- Jayakar P, Gotman J, Harvey AS, Palmini A, Tassi L, Schomer D, et al. Diagnostic utility of invasive EEG for epilepy surgery: indications, modalities, and techniques. Epilepsia. 2016; 57(11): 1735-47.
- Isnard J, Taussig D, Bartolomei F, Bourdillon P, Catenoix H, Chassoux F, et French guidelines on stereoelectrencephalography (SEEG). Neurophysiol Clin. 2018; 48(1): 5-13.
- Roessler K, Heynold E, Buchfelder M, Stefan H, Hamer HM. Current value of intraoperative electrocorticography (iopECoG). Epilepsy 2019; 91: 20-4.
- Minotti L, Montavont A, Scholly J, Tyvaert L, Taussig Indications and limits of stereoelectroencephalography (SEEG). Neurophysiol Clin. 2018; 48: 15-24.

