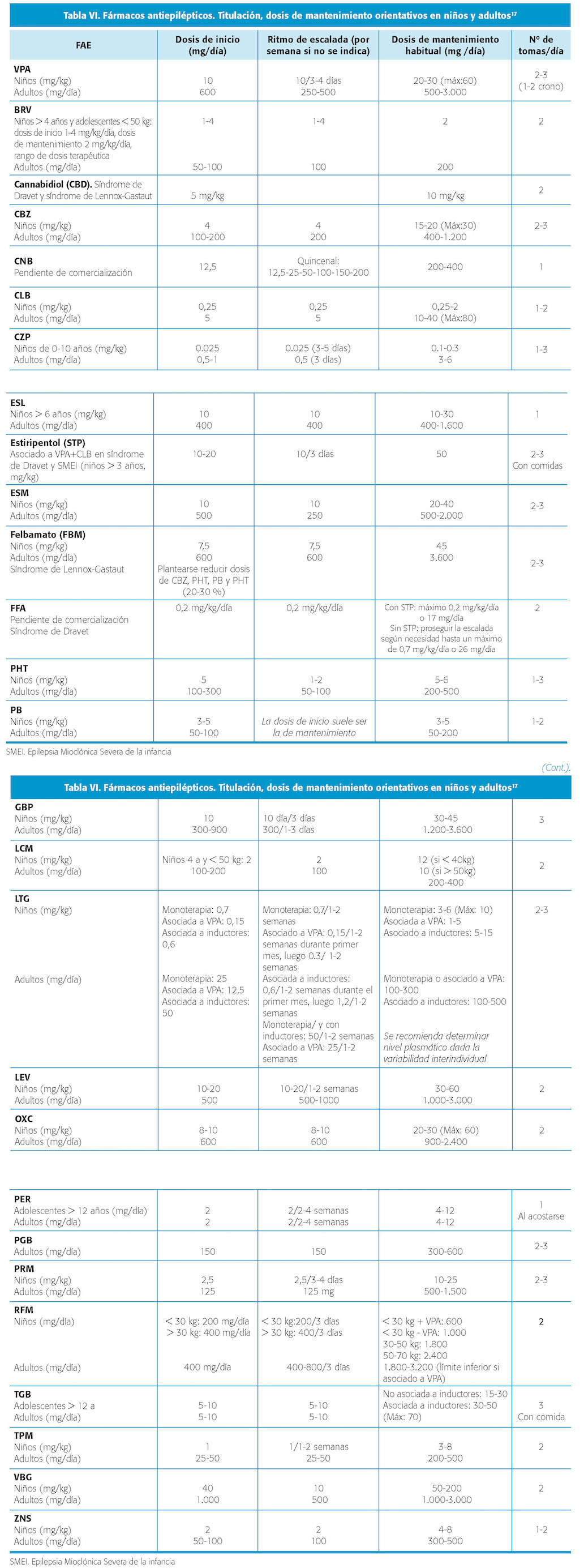
TITULACIÓN, RANGO DE DOSIS, DOSIS MÍNIMA EFICAZ, NÚMERO DE TOMAS AL DÍA
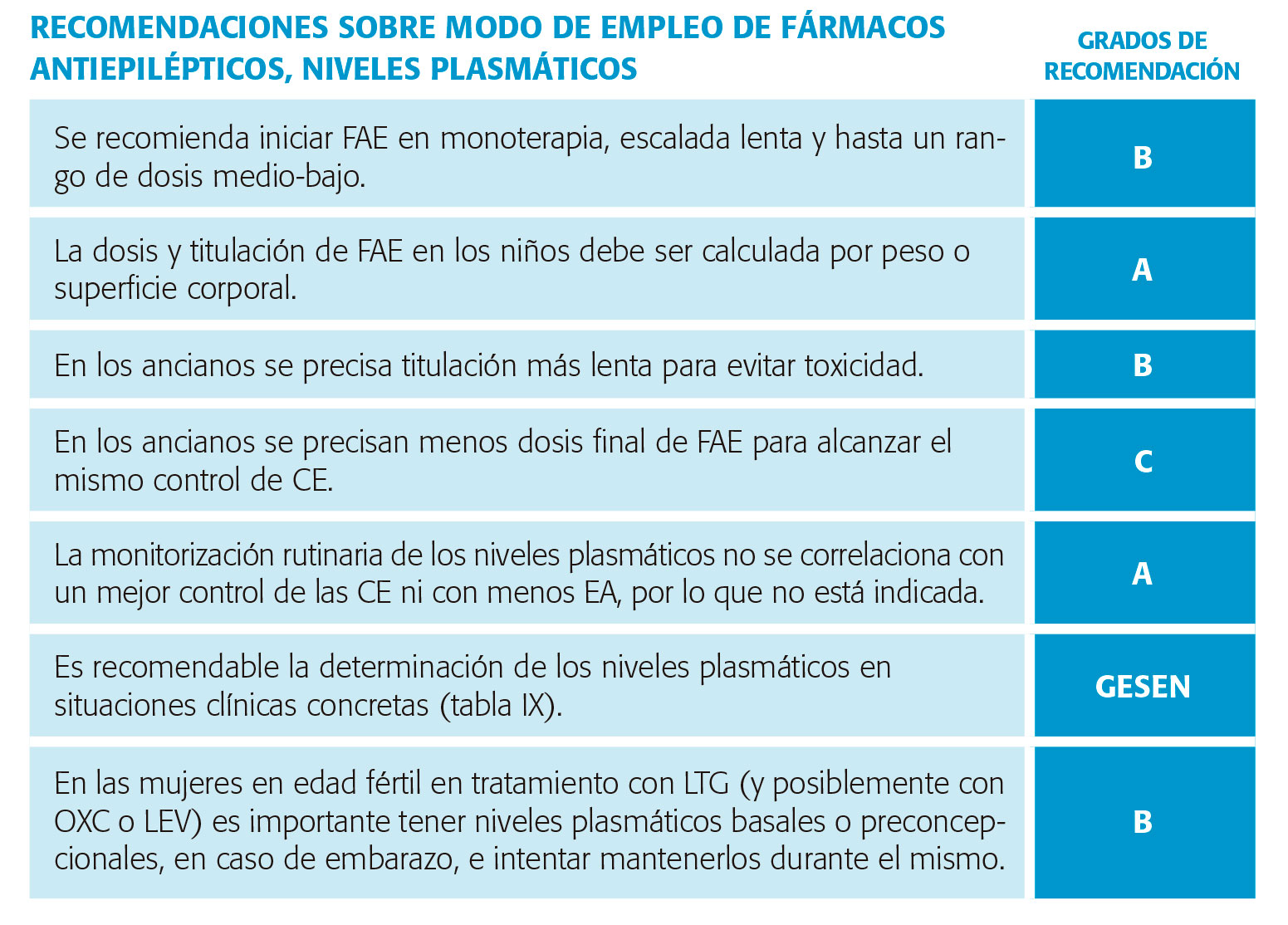
En el momento de indicar tratamiento anticrisis oral, la evidencia apoya el inicio en monoterapia desde dosis bajas, incluso menores a las descritas en ficha técnica del fármaco. Así, los estudios sobre efectividad de algunos FAC indican que la mitad de los pacientes que inician el tratamiento controlan sus crisis con monoterapia y con dosis bajas10. El empleo de dosis bajas y reevaluar la respuesta terapéutica evita el sobretratamiento y, de forma tangible, permite mejores tolerancia y adherencia al tratamiento. La titulación controlada contribuye a minimizar efectos adversos dosis-dependientes o tipo A, los más frecuentes y que en su mayoría se producen en esta fase de tratamiento.
En el anciano, la dosis inicial baja es especialmente importante debido al metabolismo enlentecido con riesgo de intolerancia (tabla V), y a que la dosis necesaria de mantenimiento con frecuencia es menor a la requerida en edades menores11.

Además de la edad, el sexo, la variabilidad genética, las comorbilidades y las interacciones con otros fármacos, influyen en el metabolismo de los fármacos, afectando tanto a la titulación ideal como a la estabilidad posterior de niveles séricos12. En el caso de politerapia con FAC, los efectos adversos dosis-dependientes de tipo neurológico (mareo, inestabilidad, diplopía, etc.) estarán relacionados con la suma de carga de dosis, además de susceptibilidad individual, por lo que, además de evitar combinaciones de FAC de similar perfil, la titulación del nuevo fármaco a añadir debe ser más lenta9.
El aumento de dosis se hará de forma paulatina, siguiendo las recomendaciones establecidas para cada FAC. Es práctica habitual llegar a la dosis máxima tolerada en caso de persistencia de crisis (CE) (tabla VI).
En niños, el inicio de tratamiento en dosis y titulación debe ser aún más controlado por su peculiaridad farmacocinética (tabla V). El efecto global es que el metabolismo y la eliminación renal están acelerados, resultando en una semivida más corta en comparación con el adulto, lo que hace necesario frecuentemente el uso de 2 o 3 tomas al día para mantener concentraciones terapéuticas13. La dosis debe ajustarse al peso y/o superficie corporal y edad debido a los cambios en administración y eliminación conforme el desarrollo12, y las vías de administración influyen en el abanico de FAC disponibles, siendo un factor condicionante en el recién nacido pretérmino. La posología en suspensión oral facilita el ajuste de dosis14. Globalmente, se requerirán dosis por peso mayores en el primer año de vida por el cociente absorción/ eliminación muy bajo a esa edad. En el caso de determinados fármacos, una relativa alta dosis de fármaco no sólo provoca efectos adversos dosis-dependientes, sino que facilita o agrava sobre todo en la edad pediátrica reacciones idiosincrásicas (concep tualmente ajenas a la dosis) tal que el síndrome de Stevens-Johnson por LTG a través de metabolitos activos o la hepatotoxicidad por VPA12.
MONITORIZACIÓN DE LOS NIVELES PLASMÁTICOS DE FÁRMACOS ANTICRISIS
La monitorización plasmática de los FAC con fines terapéuticos es un procedimiento analítico dirigido a optimizar el tratamiento. El rango terapéutico es la ventana de concentración plasmática de la sustancia donde estadísticamente existe un mayor control de la crisis y un menor riesgo de toxicidad. Por encima del límite superior, es probable la toxicidad. Distinguimos dos rangos de niveles plasmáticos:
- Rango farmacológico de referencia (niveles plasmáticos): definido por el laboratorio de una institución basado en estudios poblacionales, de tal forma que, aunque hay similitud entre centros, existen diferencias casuísticas. El neurólogo debe realizar una translación juiciosa para aplicar esa referencia poblacional a
 determinados supuestos. Como ejemplos no se requieren los mismos niveles plasmáticos de un FAC para monoterapia, politerapia, epilepsia focal, epilepsia generalizada idiopática o un estado epiléptico.
determinados supuestos. Como ejemplos no se requieren los mismos niveles plasmáticos de un FAC para monoterapia, politerapia, epilepsia focal, epilepsia generalizada idiopática o un estado epiléptico. - Rango terapéutico (nivel terapéutico): es el que se puede extraer del control absoluto de CE con y sin efectos adversos, pudiendo ser sensiblemente distinto al de laboratorio. Para determinarlo, sería necesario realizar niveles plasmáticos seriados a lo largo del tiempo y observar en qué concentraciones plasmáticas se sitúa el FAC cuando el paciente adquiere esa situación ideal. El nivel terapéutico es de máxima utilidad en la mujer en edad fértil que desee quedarse embarazada para utilizar esa concentración como objetivo durante los cambios farmacocinéticos de la gestación.
Los niveles plasmáticos de un FAC deben solicitarse en período estacionario, situación que aparece tras haber transcurrido 4-5 semividas desde el inicio del tratamiento o último cambio de dosis. Las concentraciones de referencia se refieren a los niveles plasmáticos de un fármaco en “valle”, que se alcanzan justo antes de la toma siguiente.
Para los FAC con una semivida prolongada, como ZNS, PB, PER y ESL los niveles plasmáticos apenas fluctúan entre dosis, por lo que dichos niveles se pueden obtener antes de la siguiente toma. Para el resto de FAC, con una semivida corta (< 12 horas), es preferible realizarlos a primera hora de la mañana, antes de recibir la primera dosis del día.
En la tabla VII se detallan los rangos farmacológicos de referencia conocidos de los diferentes FAC.
De los fármacos anticrisis clásicos: fenobarbital (PB), fenitoína (PHT), carbamazepina (CBZ), primidona (PRM), valproato (VPA) y etosuximida (ESM): se conocen bien sus rangos farmacológicos de referencia. Presentan propiedades desfavorables como son: farmacocinética no lineal (PHT), rango terapéutico estrecho y eliminación hepática a través del sistema del citocromo p450 por lo que sus niveles plasmáticos siguen siendo hoy día necesarios en determinados momentos.
De los fármacos anticrisis de nueva generación - gabapentina (GBP), pregabalina (PGB) lacosamida (LCM), lamotrigina (LTG), levetiracetam (LEV), oxcarbazepina (OXC), rufinamida (RUF), tiagabina (TGB), topiramato (TPM), zonisamida (ZNS), eslicarbazepina (ESL) y perampanel (PER) - sus rangos de referencia son menos conocidos y en muchos casos no se conoce la dosis mínima eficaz o la dosis máxima tolerada, o no se conoce para nuestra población. Aunque presentan un perfil farmacocinético globalmente mejor, existe una importante variación interindividual debido a polimorfismos genéticos, por lo que la determinación de sus niveles plasmáticos también puede ser útil si está disponible.
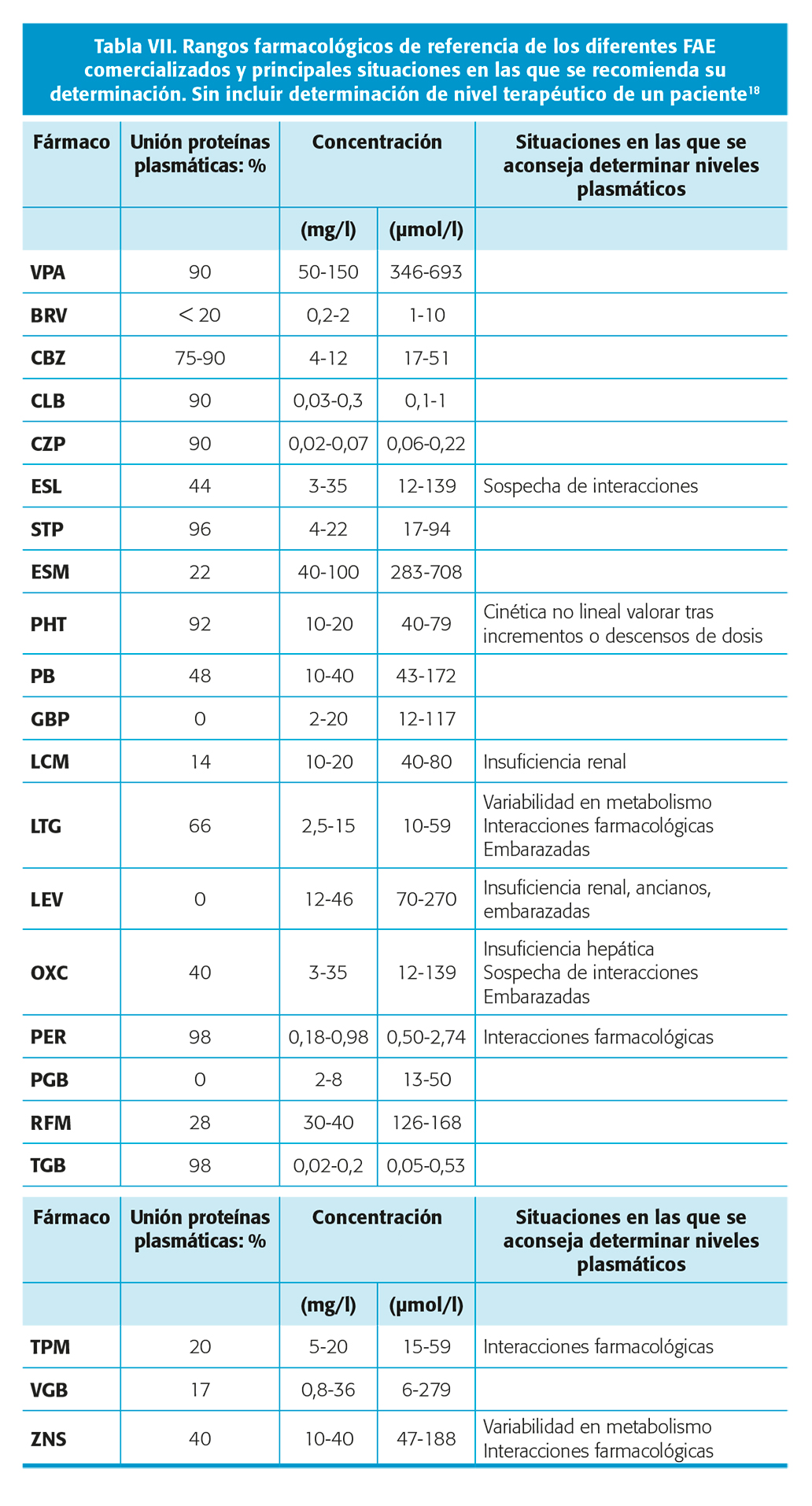
Para los FAC con alta unión a proteínas plasmáticas - PHT, CBZ, VPA, TGB, CLB, CZP y PER- en ocasiones las concentraciones totales del fármaco no permiten estimar la concentración libre, la que en último término realiza la acción terapéutica. Existen una serie de siguientes situaciones donde determinar la fracción libre está indicada (tabla VIII).
No hay evidencia de beneficio de evaluar rutinariamente niveles plasmáticos de FAC19, apoyándose finalmente por una revisión sistemática20. Los pacientes no estaban mejor controlados ni presentaban menos efectos adversos. Sin embargo, esto no excluye su evaluación en determinadas situaciones, politerapia y pacientes seleccionados. En la tabla IX se establecen las situaciones clínicas donde estaría indicada la determinación de niveles plasmáticos.

En el caso en particular del embarazo, se acepta que el descenso en las concentraciones de los FAC son el principal factor responsable del empeoramiento de las CE. Entre las causas de ello, existe un aumento del metabolismo mediante CYP o glucuronidación y un incremento del filtrado glomerular. Por otro lado, la concentración libre de fármacos con alta unión a proteínas está menos comprometida. Respecto a los nuevos FAC, se dispone de más información acerca de LTG, que puede sufrir una reducción de su nivel plasmático en más del 50 %, pero cifras similares se encontraron para OXC y LEV24,25. En el caso de estos fármacos, es recomendable la determinación preconcepción, que marcaría en caso de control el nivel terapéutico, durante el embarazo y en el puerperio, con las consiguientes modificaciones.

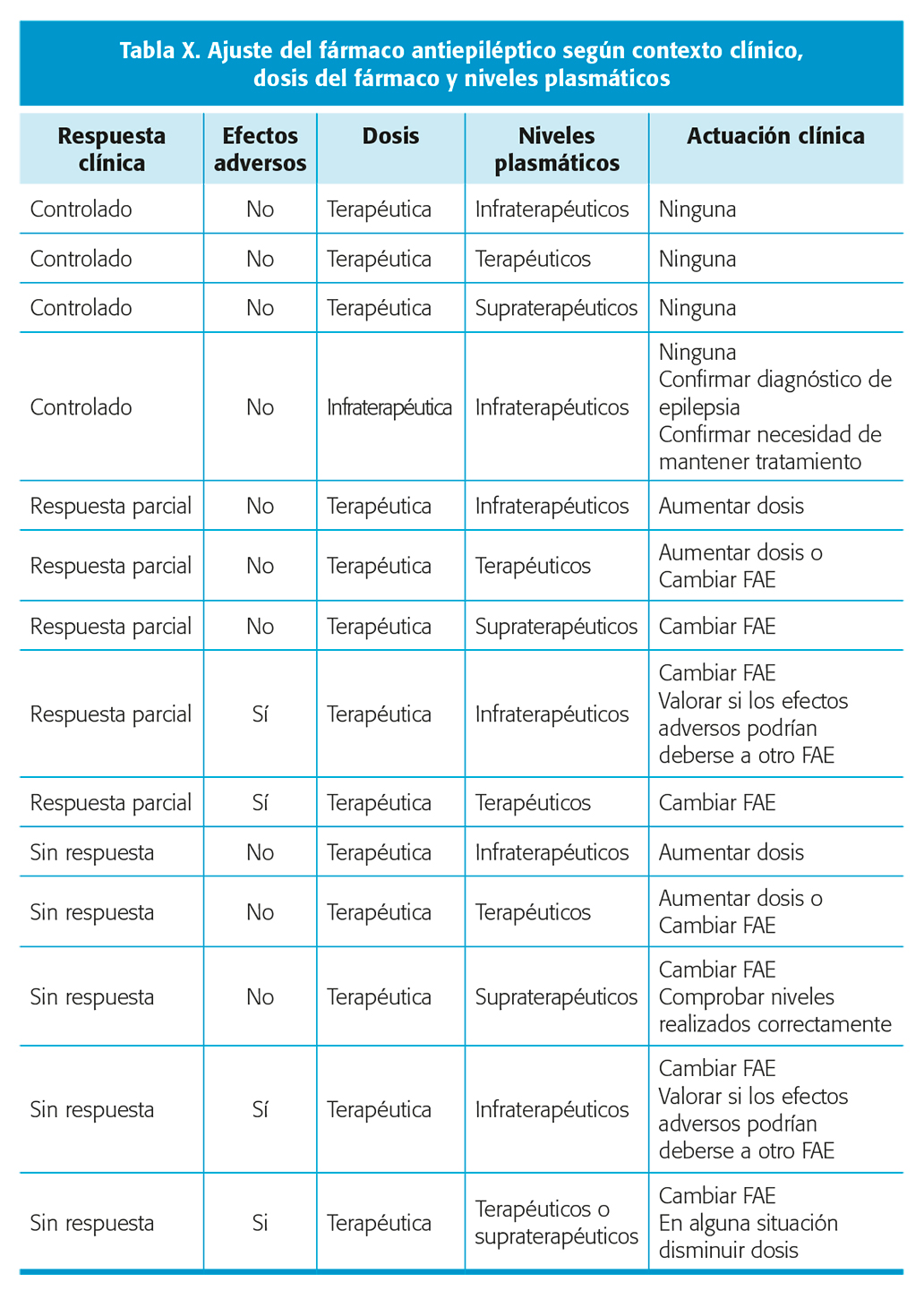
La correlación entre la respuesta clínica, los EA dosis-dependiente y los niveles plasmáticos determina unas pautas de actuación clínica que se detallan en la tabla X.
FÁRMACOS ANTICRISIS GENÉRICOS
La EMEA conceptúa fármaco genérico (FG) como todo aquel fármaco que tenga la misma composición cualitativa y cuantitativa en principios activos, la misma forma farmacéutica y cuya bioequivalencia con el fármaco innovador (FI) de referencia haya sido demostrada en estudios de biodisponibilidad.
En nuestro país se los reconoce con las siglas EFG (correspondientes a equivalente farmacéutico genérico) y son autorizados (Ley 29/2006, de 26 de julio, BOE n.º 178) con la finalidad de que puedan intercambiarse con el FI o entre diferentes fármacos genéricos, sin licencia de la compañía innovadora y una vez extinguido el tiempo de patente, a un precio considerablemente inferior al de marca. Esto es posible al no estar la empresa que los comercializa obligada a invertir en su investigación, desarrollo y promoción (I+D) ni tener la necesidad de un departamento médico o de un stock constante.
Los FAC con versiones genéricas aprobados por la EMEA son: CBZ, GBP, LTG, LEV, PGB, OXC, TPM, LCM, ZNS.
Conceptos de bioequivalencia, biodisponibilidad y equivalencia terapéutica
Dos productos son bioequivalentes si su biodisponibilidad, después de ser administrados a la misma dosis molar, es tan semejante que sus efectos en cuanto a eficacia y seguridad son en esencia idénticos.
La biodisponibilidad es la velocidad a la que se absorbe una sustancia o fracción activa, y la cantidad de ella que llega a los receptores titulares en los que debe actuar. Sin embargo, también se admite en términos prácticos la biodisponibilidad como la velocidad y cuantía con que el fármaco alcanza la circulación general.
Una equivalencia terapéutica entre medicamentos exige que se haya comprobado clínicamente su eficacia, seguridad y tolerabilidad, como lo hacen los FI para ser aprobados tras los ensayos pertinentes. Sin embargo, la EMEA y la FDA admiten que, demostrándose la bioequivalencia entre el FG y el FI, hay garantía suficiente de igualdad, con la condición de que este producto contenga excipientes inactivos estandarizados. No son, por tanto, necesarios ensayos clínicos que demuestren esta equivalencia.
Demostración de bioequivalencia
La demostración de bioequivalencia entre el FI y el FG se lleva a cabo comparando esencialmente tres parámetros farmacocinéticos: el área bajo la curva concentración-tiempo (AUC) (indicativa de la cantidad absorbida, y la concentración plasmática máxima [Cmax]) y tiempo empleado en alcanzar ésta (Tmáx) (indicativos del grado y velocidad de absorción). Estos datos se extraen tras administrar dosis únicas o repetidas en idéntica cantidad molar del principio activo de las dos formulaciones, en distintos momentos, a un número “adecuado”12-36 de individuos voluntarios sanos, generalmente de entre 21 y 35 años (18-55 años), dentro del 10 % de su peso ideal, y analizando si los valores medios obtenidos a partir de sus niveles séricos son semejantes.
Requisitos de las agencias reguladoras internacionales para la autorización de fármacos genéricos
Las agencias reguladoras internacionales, a efectos de autorización, aceptan que dos formulaciones son bioequivalentes y, por extensión, similares terapéuticamente, cuando el 90 % del intervalo de confianza (IC) de la relación entre FG y FI, para el AUC y la Cmax, quede dentro del rango ± 20 %. Esto, en datos transformados logarítmicamente con fines estadísticos, equivalen a entre el 80 % y el 125 %. No debemos confundir biodisponibilidad con contenido de principio activo. Las variaciones permitidas de hasta el 40 % en realidad deben aceptar que la concentración media en sangre después de la administración del FG no difiere más de un 5-7 % de la observada con el FI.
¿Contamos con evidencias para rechazar o indicar el uso de fármacos genéricos?
Existe en la actualidad suficiente evidencia para afirmar que la mayoría de genéricos son bioequivalentes al fármaco original y que no existe riesgo de empeoramiento tanto en el control de crisis como en aumento de toxicidad en su sustitución26-29. Esto ha llevado a que las recomendaciones de la Asociación Americana de Epilepsia hayan cambiado y desde el 2016 se considera que la sustitución de las diferentes formulaciones de FAC es segura para los pacientes30. Sin embargo, a pesar de esa razonable seguridad, otras guías actuales especifican evitar cambios en pacientes no controlados en politerapia y en general de forma rutinaria29,30.

Bibliografía
- Brodie MJ, Barry SJE, Bamagous GA, Norrie JD, Kwan P. Patterns of treatment response in newly diagnosed Neurology. 2012; 78(20): 1548-54.
- Besocke AG, Rosso B, Cristiano E, Valiensi SM, García Mdel C, Gonorazky SE, et Outcome of newly-diagnosed epilepsy in older patients. Epilepsy Behav. 2013; 27: 29-35.
- Guerrini R, Parmeggiani Practitioner review: use of antiepileptic drugs in children. J Child Psychol Psychiatry. 2006; 47: 115-26.
- Anderson GD. Children versus adults: pharmacokinetic and adverse-effect differen Epilepsia. 2002; 43 (Suppl 3): S53-9.
- Rufo-Campos M, Carreño M. Utilización de carbamazepina y oxcarbazepina en pacientes pediátricos con epilepsia parcial en España. Estudio observacional. Neurolo 2009; 24: 30-9.
- Gilman JT, Duchowny M, Campo AE. Pharmacokinetic considerations in the treatment of childhood Paediatr Drugs. 2003; 5: 267-77.
- Patsalos PN, Berry DJ, Bourgeois BF, Cloyd JC, Glauser TA, Johannessen SI, et al. Antiepileptic drugs-best practice guidelines for therapeutic drug monitoring: a position paper by the subcommission on therapeutic drug monitoring, ILAE Commission on Therapeutic Epilepsia. 2008; 49: 1239-76.
- Fichas técnicas de diversos fármacos comercializados en la Unión Europea. https:// europa.eu/health/documents/
- Patsalos PN, Spencer EP, Berry DJ. Therapeutic drug monitoring of antiepileptic drugs in epilepsy: a 2018 Ther Drug Monit. 2018; 40(5): 526-48.
- Jannuzzi G, Cian P, Fattore C, Gatti G, Bartoli A, Monaco F, et A multicenter randomized controlled trial on the clinical impact of therapeutic drug monitoring in patients with newly diagnosed epilepsy. The Italian TDM Study Group in Epilepsy. Epilepsia. 2000; 41: 222-30.
- Tomson T, Dahl M, Kimland E. Therapeutic monitoring of antiepileptic drugs for epi Cochrane Database Syst Rev. 2007; CD002216.
- Verrotti A, Iapadre G, Di Donato G, Di Francesco L, Zagaroli L, Matricardi S, et al. Pharmacokinetic considerations for anti-epileptic drugs in children. Expert Opin Drug Metab 2019; 15(3): 199-211.
- Voinescu PE, Park S, Chen LQ, Stowe ZN, Newport DJ, Ritchie JC, et al. Antiepileptic drug clearances during pregnancy and clinical implications for women with epilepsy. 2018; 91: e1228-e1236.
- Asconape JJ. Use of antiepileptic drugs in hepatic and renal disease. Handb Clin 2014; 119: 417-32.
- Tomson T, Landmark CJ, Battino D. Antiepileptic drug treatment in pregnancy: changes in drug disposition and their clinical Epilepsia. 2013; 54: 405-14.
- Harden CL, Pennell PB, Koppel BS, Hovinga CA, Gidal B, Meador KJ, et Management issues for women with epilepsy–focus on pregnancy (an evidence-based review): III. Vitamin K, folic acid, blood levels, and breasd-feeding. Report of the Quality Standards Subcommittee and Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology and the American Epilepsy Society. Epilepsia. 2009; 50: 247-55.
- Holtkamp M, Theodore Generic antiepileptic drugs-safe or harmful in patients with epilepsy? Epilepsia. 2018; 59(7): 1273-81.
- Kesselheim AS, Bykov K, Gagne JJ, Wang SV, Choudhry NK. Switching generic antiepileptic drug manufacturer not linked to seizures. A case-crossover study. Neurology. 2016; 87: 1796-801.
- Karalis V, Macheras P, Bialer M. Generic products of antiepileptic drugs: a perspective on bioequivalence, bioavailability, and formulation switches using Monte Carlo simu CNS Drugs. 2014; 28(1): 69-77.
- Hansen RN, Nguyen HP, Sullivan Bioequivalent antiepileptic drug switching and the risk of seizure-related events. Epilepsy Res. 2013; 106(1-2): 237-43.
- American Epilepsy Substitution of different formulations of antiepileptic drugs for the treatment of epilepsy 2016. Available at: https://www.aesnet.org/about_aes/ generic-position-statement. Accessed September 16, 2016.

