INTRODUCCIÓN
El desarrollo y consolidación de diversos tratamientos no quirúrgicos, como la neuroestimulación o las dietas cetogénicas, y de procedimientos de cirugía mínimamente invasiva, han ampliado el abanico terapéutico del que disponemos para el manejo de la epilepsia refractaria. En este capítulo revisaremos la evidencia acumulada en los últimos años sobre estas terapias.
NEUROESTIMULADORES
Los métodos de neuroestimulación se consideran tratamientos paliativos para pacientes con epilepsia farmacorresistente no tratados mediante cirugía, que presentan mecanismos de acción diferentes a los fármacos, un perfil distinto de efectos adversos, garantizan el cumplimiento terapéutico y es posible que no supongan un riesgo añadido de teratogenia. Se considera que son eficaces cuando se alcanza una reducción de la frecuencia de crisis igual o superior al 50 % de la frecuencia de crisis basal.
Estimulación del nervio vago
Supone un sistema de estimulación de localización extracraneal. Su empleo fue aprobado en Europa en 1994 como tratamiento coadyuvante para pacientes con epilepsia refractaria focal no candidatos a cirugía resectiva mayores de 12 años. Con los años se amplió su uso a niños, ancianos y epilepsias generalizadas.
Consta de un electrodo helicoidal que se dispone alrededor del nervio vago, un generador situado en la región infraclavicular, un cable que conecta ambos elementos, y un imán de uso externo52.
El nervio vago tiene un 80 % de fibras aferentes que proyectan hacia el tronco cerebral y el encéfalo, con múltiples conexiones corticales. El dispositivo emite de forma periódica un estímulo que se transmite desde el generador hasta el nervio vago a través del electrodo de estimulación, y asciende siguiendo el trayecto de sus fibras aferentes. También se puede inducir una estimulación extra con el imán aplicándolo sobre el generador. El otro 20 % son fibras eferentes e inervan, entre otras, a la musculatura de laringe y faringe, lo que condiciona la mayoría de efectos secundarios. El ENV se implanta en el nervio vago izquierdo para evitar la mayor influencia del vago derecho sobre el ritmo cardiaco.
Los nuevos generadores permiten una estimulación inducida por la presencia de una taquicardia ictal, programar varios ajustes secuenciales de parámetros o establecer dos modos de estimulación cada 24 horas (modo “diurno” y “nocturno”).
Contraindicaciones
Las contraindicaciones absolutas y relativas se describen en la tabla X.

Complicaciones
Relacionadas con la cirugía: infecciones (3-8 %), hemorragias, asistolia (1/1.000), o parálisis aguda de cuerda vocal.
Efectos a medio-largo plazo secundarios a la ENV: son dependientes de la intensidad de la estimulación y fácilmente controlables con los ajustes de ésta. Los más frecuentes son disfonía, tos, dolor cervical, molestias faríngeas o disnea.
Manejo práctico
El generador se activa unas 2 semanas tras la implantación. El sistema dispone de una sonda transcutánea y una tableta de datos para el ajuste de los parámetros.
La corriente de salida se ajusta a parámetros estándar (intensidad inicial 0,25 mA, frecuencia de señal de 20/30 Hz, ancho de pulso de 250/500 microsegundos, tiempo on de emisión del estímulo de 30 segundos y tiempo off de descanso entre estímulos de 5 minutos)51. En sucesivas revisiones se incrementa la intensidad del estímulo a intervalos de 0,25 mA hasta alcanzar eficacia, intensidad máxima (3 mA) o efectos adversos no tolerables. Cuando el aumento de intensidad no resulta eficaz
o aparecen efectos adversos se puede cambiar a un ciclo intermedio o rápido de estimulación (variando los periodos on rebajando la intensidad del estímulo), sin que el tiempo on llegue a sobrepasar al off (fig. 3).
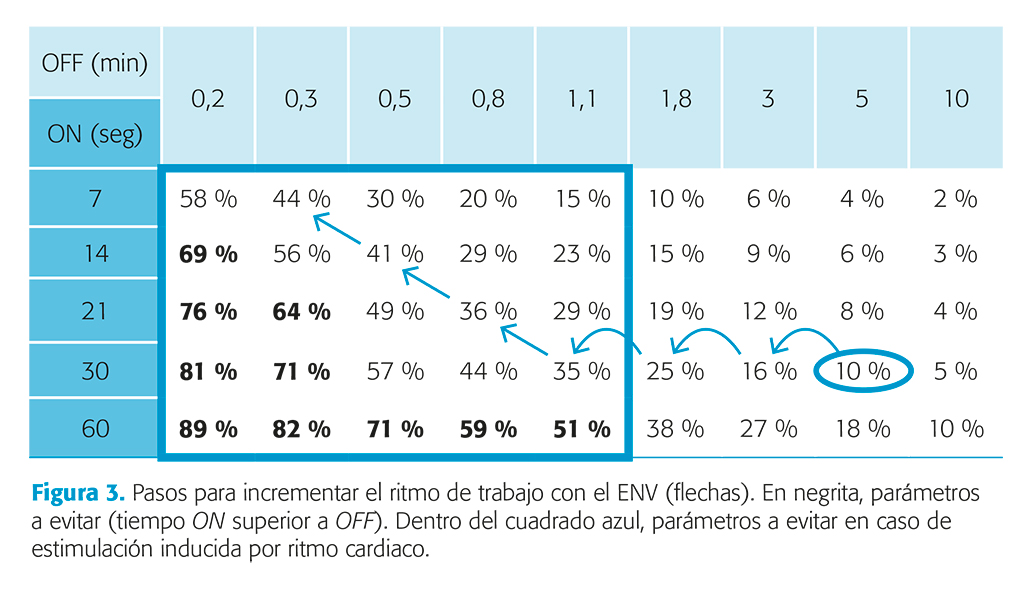
Eficacia
La aprobación del ENV para uso clínico se basó en los resultados de 2 ensayos clínicos (EO3 y EO5). Su seguimiento en abierto mostró una tasa de respondedores al año del 44,4 % y a los 5 años del 64,4 %. En un reciente metanálisis de 5.554 pacientes se evidenció una eficacia del 63 % entre los 2-4 años de estimulación y un 8,2 % de libertad de crisis53. Nivel de evidencia I. Hay evidencia de eficacia en población pediátrica, y se ha visto un especial beneficio en crisis asociadas al síndrome de Lennox-Gastaut (SLG) y en pacientes con comorbilidad depresiva54. Nivel de evidencia II. Y su uso se ha ampliado a otras epilepsias generalizadas, pacientes ancianos o pacientes con estados epilépticos de repetición, entre otras. Nivel de evidencia IV. La eficacia del estimulador mejora con el tiempo, especialmente en los dos primeros años.
Estimulación cerebral profunda
Se trata de un sistema de estimulación intracraneal que proporciona una estimulación de forma programada con diana en el núcleo anterior del tálamo. Para ello se implantan electrodos profundos de forma bilateral en este núcleo y se conectan a un generador localizado en la región infraclavicular izquierda, modulando o interrumpiendo la propagación de crisis por el circuito límbico. Su empleo se aprobó tras conocerse los resultados del estudio SANTE. Nivel de evidencia I. A los 5 años el 68 % de los pacientes eran respondedores55. Por su implicación en el circuito de Papez existe riesgo de afectación anímica y de memoria.
Estimulación inducida por crisis
Supone un tipo de estimulación intracraneal que incluye un software capaz de detectar crisis electroencefalográficas espontáneas y de emitir una estimulación eléctrica de forma inmediata55. El dispositivo se implanta en el cráneo y va conectado a 1-2 electrodos intracraneales (profundos o tiras subdurales). Implica un conocimiento previo de la localización de la zona epileptógena. Su empleo está aprobado en EEUU pero no en Europa. Nivel de evidencia I.
Otras técnicas de neuroestimulación
La estimulación trigeminal es un tratamiento no invasivo aprobado como adyuvante en ERF en adultos y niños mayores de 9 años. Se colocan unos electrodos adheridos sobre la frente y se conectan a un estimulador, que envía un estímulo eléctrico al nervio trigémino con una determinada frecuencia e intensidad regulable. La respuesta clínica es discreta con una disminución de la frecuencia de crisis del 35 % a los 12 meses y del 14 % a los 48 meses56.
Indicaciones y comparación entre los sistemas de neuroestimulación (tabla XI)55.
DIETAS CETOGÉNICAS
Tienen una gran difusión entre pacientes pediátricos y su empleo en adultos cada vez es mayor. Su objetivo consiste en generar una situación de cetosis similar al ayuno restringiendo los hidratos de carbono y empleando grasas como fuente de energía57.
Se distinguen 4 tipos de dietas cetogénicas (DC):
- Dieta cetógena clásica: muy rica en grasas (90 %), sobre todo triglicéridos de cadena larga, con contenido bajo en glúcidos y adecuada cantidad de proteí Puede ser 4:1 (4 g de grasa por 1 g de glúcidos y proteínas) o 3:1.
- Dieta modificada de Atkins: se limita la cantidad de carbohidratos y se promueve el consumo de grasas, sin restricción de fluidos, lípidos o proteínas. Estaría indicada para pacientes con dificultades para cumplir la dieta cetógena clásica.
- Dieta de bajo índice glucémico: acepta mayores aportes de glúcidos, mientras que su índice glucémico sea inferior a 50.
- Dieta de triglicéridos de cadena media: hay mayor proporción de este tipo de ácidos grasos, que contienen más calorías y consiguen con rapidez una buena cetosis, lo que permite disminuir el % total de grasas de la dieta. Consigue mayor palatabilidad, pero la intolerancia digestiva es mayor.
Indicaciones
Las DC están indicadas en pacientes niños y adultos con epilepsia refractaria. Nivel de evidencia I. Es el tratamiento de elección en el déficit de la proteína 1 transportadora de glucosa (GLUT-1) y en el déficit de piruvato-deshidrogenasa. En estas situaciones el cerebro no puede emplear la glucosa y necesita fuentes alternativas de energía por lo que la DC debe introducirse precozmente. Nivel de evidencia III. También ha resultado útil en determinadas encefalopatías epilépticas, como el síndrome de West, el síndrome de Lennox-Gastaut o el síndrome de Ohtahara, o en epilepsias focales en espera de cirugía58.
Contraindicaciones
Todas las patologías que supongan una alteración en el metabolismo de los ácidos grasos o las que requieran dosis elevadas de carbohidratos en la dieta (déficits de la gluconeogénesis, trastornos de la b-oxidación de ácidos grasos, déficit primario de carnitina o porfiria aguda intermitente)57,58.
Método de empleo
Se puede iniciar de forma extrahospitalaria si se realizan controles rigurosos del estado metabólico y nutricional. Se calculan los requerimientos energéticos diarios y se planifica la dieta, administrando suplementos vitamínicos y calcio entre otros. Es importante vigilar la aparición de hipoglucemias, hipercetosis y acidosis metabólica y controlar la frecuencia de crisis del paciente. Se instruye para monitorizar en domicilio las determinaciones de cetonas y los controles necesarios. Si no hay respuesta, se suspende en unos 3 meses. En caso de buena respuesta se mantiene 2 años, o incluso más (déficit de GLUT-1, déficit de piruvato-deshidrogenasa o eficacia > 90 %). La retirada debe ser progresiva salvo aparición de complicaciones graves57,58.
Eficacia
Su empleo en epilepsia está avalado por dos ensayos clínicos. El primero, con DC clásica o de triglicéridos de cadena media, en niños de 2-16 años, mostró respuesta en el 38 % de pacientes (6 % en el grupo placebo) y un 7 % de eficacia > 90 %. El segundo, con dieta modificada de Atkins, obtuvo respuestas del 52 % a 3 meses (12 % del grupo placebo) y un 30 % con eficacia >90 %. Nivel de evidencia I. Una revisión Cochrane reciente revisa 11 ensayos clínicos en población infantil (n = 712) y adulta (n = 66) con resultados beneficiosos, concluyendo que las DC muestran resultados prometedores en epilepsia59.
Efectos adversos
Las complicaciones agudas suceden tras su inicio o con circunstancias estresantes para el organismo (fiebre, infección, etc.). Las más temidas son las metabólicas. Es necesario prevenir y tratar deshidrataciones, acidosis, hiperuricemias, hipocalcemias, hipomagnesemias, hipercetonemias o hipoproteinemias. Lo más frecuente son las manifestaciones digestivas (vómitos, diarrea, estreñimiento). Es necesario vigilar estrechamente la aparición de hipoglucemia. A medio-largo plazo también pueden aparecer complicaciones generalmente transitorias y menos graves: hiperlipidemia, nefrolitiasis (es frecuente y conviene prevenirla con hidratación adecuada de administracion de citrato y de citrato potásico oral para alcalinizar la orina), alteraciones gastrointestinales (náuseas-vómitos, diarrea, estreñimiento, hepatopatías o pancreatitis; son los más frecuentes y los que condicionan mayores abandonos), déficits vitamínicos, de iones (incluyendo vitamina D, calcio o fósforo, que facilitan alteraciones del desarrollo óseo o fracturas; o selenio, con riesgo de cardiopatías).
TÉCNICAS DE CIRUGÍA MÍNIMAMENTE INVASIVA
En los últimos años se han establecido tratamientos ablativos poco invasivos para el abordaje quirúrgico de la epilepsia refractaria. Las técnicas desarrolladas han sido tanto no invasivas (radiocirugía estereotáctica), como mínimamente invasivas (termocoagulación con radiofrecuencia, terapia térmica intersticial con láser). Estas técnicas suponen actualmente una alternativa a la cirugía convencional en algunos pacientes, llegando incluso a sustituir a la cirugía tradicional en algunas indicaciones.
Radiocirugía estereotáctica
La radiocirugía estereotáctica (RE) es el procedimiento mínimamente invasivo con más respaldo bibliográfico en el tratamiento de la epilepsia. La mayoría de estudios con RE en epilepsia se han realizado utilizando el sistema Leksel Gamma Knife® (GK), existiendo menos publicaciones con los aceleradores lineales. No existen por el momento estudios comparativos entre estas técnicas60.
La indicación de RE que posee una mayor evidencia es la epilepsia del lóbulo temporal medial (ELTM). En 2018 se publicó el primer ensayo clínico aleatorizado, comparando el GK con la cirugía convencional (ROSE trial, nivel de evidencia I)51. En este ensayo hubo una mayor proporción de pacientes libres de crisis en el grupo de cirugía convencional (78 %) que en el de GK (52 %, p = 0,82 para no-inferioridad). Con respecto a los efectos adversos, se observó una menor afectación de campo visual y de memoria verbal en el grupo de GK, sin alcanzarse significación estadística. Tanto la eficacia como los efectos adversos se observaron inmediatamente tras el procedimiento en el grupo de cirugía convencional y con una latencia de 1,5-2 años en el de GK. Estos datos son superponibles a los que se han encontrado en estudios observacionales prospectivos publicados previamente. Niveles de evidencia II-III60. En estudios recientes se ha observado la utilidad del GK como tratamiento en pacientes con ELTM en los que ha fallado previamente la cirugía convencional, tratando el remanente o áreas adyacentes. Nivel de evidencia III61.
La segunda indicación con mayor evidencia de la RE es la epilepsia relacionada con el hamartoma hipotalámico (HH). Se han publicado numerosas series retrospectivas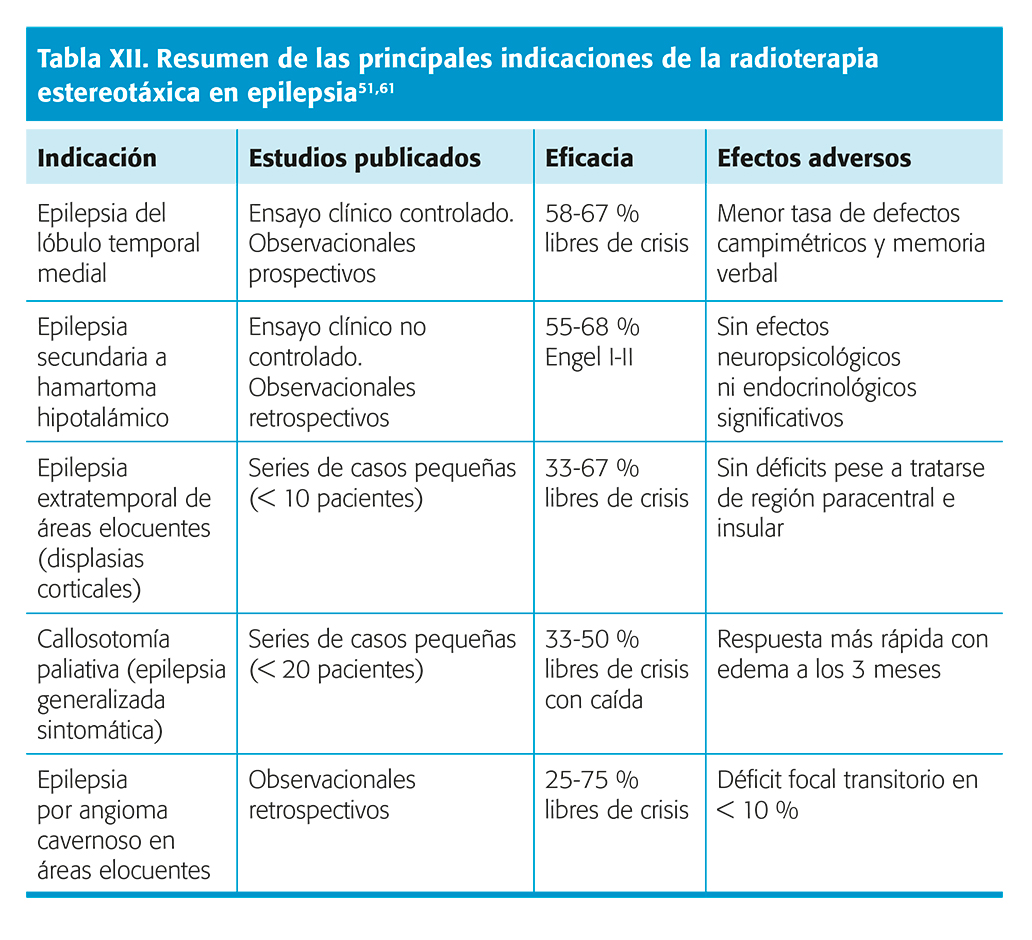 y, en 2017, el primer ensayo clínico no controlado. Nivel de evidencia II62. En este ensayo se observó una proporción alta de pacientes con Engel I-II (68 %), con mejoría o resolución de la comorbilidad psiquiátrica en un 72 %. Además, no aparecieron déficits neuropsicológicos ni endocrinológicos relevantes, al contrario de lo que se observa en pacientes tratados con técnicas de cirugía convencional. La latencia para la mejoría en estos pacientes es similar a la encontrada en la ELTM. La respuesta fue mejor en HH de menor tamaño. Las indicaciones de RE se resumen en la tabla XII.
y, en 2017, el primer ensayo clínico no controlado. Nivel de evidencia II62. En este ensayo se observó una proporción alta de pacientes con Engel I-II (68 %), con mejoría o resolución de la comorbilidad psiquiátrica en un 72 %. Además, no aparecieron déficits neuropsicológicos ni endocrinológicos relevantes, al contrario de lo que se observa en pacientes tratados con técnicas de cirugía convencional. La latencia para la mejoría en estos pacientes es similar a la encontrada en la ELTM. La respuesta fue mejor en HH de menor tamaño. Las indicaciones de RE se resumen en la tabla XII.
Termocoagulación por radiofrecuencia
La termocoagulación por radiofrecuencia guiada por estéreo-EEG (E-EEG) con electrodos profundos se basa en los siguientes principios: se realiza en la zona de inicio ictal detectada por E-EEG, los electrodos son los mismos utilizados para el registro de E-EEG (por lo que no aumenta el riesgo quirúrgico por implantación per se), se puede realizar un mapeo funcional e inducir crisis mediante estimulación eléctrica con los mismos electrodos, y la termocoagulación no requiere anestesia.
En global, las series retrospectivas de casos publicadas hasta el momento (la mayor con 162 pacientes) muestran unos resultados similares de eficacia, con un 50 % de pacientes con reducción > 50 % de las crisis, y menos de un 10 % de pacientes libres de crisis al año63. Los estudios a largo plazo muestran que el 58 % de respondedores mantienen la eficacia. En epilepsias no lesionales, la mejoría con termocoagulación predice una mayor probabilidad de éxito con la cirugía convencional posterior, si esta es necesaria. Las series de epilepsias lesionales (displasias corticales, heterotopias o tumores neurogliales) muestran tasas de libertad de crisis mayores, entre el 15 y el 85 %. Se han publicado déficits focales transitorios o permanentes leves en < 2 %.
Terapia térmica intersticial con láser
La terapia térmica intersticial con láser (TTIL) guiada por resonancia magnética es una técnica mínimamente invasiva que se realiza con anestesia local, requiriendo únicamente un trépano similar al necesario para la implantación de electrodos profundos y 24 horas de ingreso. Hasta la fecha, se han publicado series pequeñas y de seguimiento corto, con datos variables de eficacia en cada indicación: en ELTM (series de hasta 25 pacientes, 32-60 % de los pacientes con Engel I-II), en epilepsia por HH (series de < 15 pacientes, 50-85 % libres de crisis), o en epilepsia por angioma cavernoso y displasias corticales (series de < 5 pacientes, 40-80 % libres de crisis). Aunque los resultados neuropsicológicos tienden a ser mejores que con cirugía convencional, estos datos tendrán que ser corroborados por estudios de mayor tamaño y seguimiento64.
Bibliografía
- Barbaro NM, Quigg M, Ward MM, Chang EF, Broshek DK, Langfitt JT, et al. Radiosurgery versus open surgery for mesial temporal lobe epilespy: the randomized, controlled ROSE Epilepsia. 2018; 59: 1198-207.
- Wheless JW, Gienapp AJ, Ryvlin P. Vagus nerve stimulation (VNS) therapy update. Epilepsy 2018; 88S: 2-10.
- Englot DJ, Birk H, Chang Seizure outcomes in non-resective epilepsy surgery: an update. Neurosurg Rev. 2017; 40: 181-94.
- Ghani S, Vilensky J, Turner B, Tubbs RS, Loukas M. Meta-analysis of vagus nerve stimulation treatment for epilepsy: correlation between device setting parameters and acute Childs Nerv Syst. 2015; 31: 2291-304.
- Dalkilic EB. Neurostimulation devices used in treatment of epilepsy. Curr Treat Options 2017; 19: 7.
- Olivié L, Giraldez BG, Sierra-Marcos A, Díaz-Gómez E, Serratosa External trigeminal nerve stimulation: a long term follow study. Seizure. 2019; 69: 218-20.
- Schoeler NE, Cross JH. Ketogenic dietary therapies in adults with epilepsy: a practical Practical Neurol. 2016; 16: 208-14.
- Van der Louw E, van der Hurk D, Neal E, Leiendecker B, Fitzsimmon G, Dority L, et Ketogenic diet guidelines for infants with refractory epilepsy. Eur J Paediatr Neurol. 2016; 20: 798-890.
- Martin-McGill KJ, Jackson CF, Bresnahan R, Levy RG, Cooper PN. Ketogenic diets for drug-resistant Cochrane Database Syst Rev. 2018; 11: CD001903.
- McGonigal A, Sahgall A, de Salles A, Hayashi M, Levivier M, Ma L, et Radiosurgery for epilepsy: Systematic review and International Stereotactic Radiosurgery Society (ISRS) practice guideline. Epilepsy Res. 2017; 137: 123-31.
- Lee EM, Kang JK, Kim SJ, Hong SH, Ko TS, Lee SA, et Gamma Knife radiosurgery for recurrent or residual seizures after anterior temporal lobectomy in mesial temporal lobe epilepsy patients with hippocampal sclerosis: long-term follow-up results of more than 4 years. J Neurosurg. 2015; 123: 1375-82.
- Régis J, Lagmari M, Carron R, Hayashi M, McGonigal A, Daquin G, et al. Safety and efficacy of Gamma Knife radiosurgery in hypothalamic hamartomas with severe epilepsies: a prospective trial in 48 patients and review of the literature. Epilepsia. 2017; 58(Suppl 2): 60-71.
- Bourdillon P, Devaux B, Job-Chapron AS, Isnard J. SEEG-guided radiofrequency ther Neurophysiol Clin. 2018; 48: 59-64.
- Hoppe C, Witt JA, Helmstaedter C, Gasser T, Vatter H, Elger CE. Laser interstitial thermotherapy (LiTT) in epilepsy Seizure. 2017; 48: 45-52.

