EPILEPSIA FARMACORRESISTENTE
Introducción
Afortunadamente, alrededor de un 60-70 % de pacientes con epilepsia se controlan con tratamiento farmacológico. No obstante, hasta un tercio de los pacientes seguirán presentando crisis pese a los fármacos anticrisis (FAC) disponibles. Este subgrupo de pacientes con una epilepsia no controlada tiene más riesgo de exclusión social y laboral, accidentes y muerte prematura, así como una peor calidad de vida. Por ese motivo, es importante definir cuándo un paciente es refractario a los fármacos anticrisis al poderse beneficiar de otros tratamientos que no son necesariamente farmacológicos.
Definición
La Liga Internacional contra la Epilepsia (ILAE)1 define como epilepsia refractaria a fármacos anticrisis o farmacorresistente (EFR) a aquella en la que “ha fracasado el ensayo terapéutico con dos FAC (en monoterapia o en combinación), que han sido bien tolerados y adecuadamente seleccionados y empleados, para conseguir una libertad de crisis mantenida en el tiempo” (tabla I). Esta clasificación se basa en diferentes estudios que muestran que, cuando fallan dos FAC, la posibilidad de una respuesta completa con nuevos intentos terapéuticos se reduce sustancialmente2-4. Se define como libertad de crisis1 a la ausencia de cualquier tipo de crisis (también auras), durante un periodo de tiempo que debe ser:
- Superior a tres veces el intervalo de tiempo más largo entre crisis que el paciente tuvo en el año previo al inicio del nuevo ensayo terapéutico o…
- … superior a los 12 meses desde que se inició el nuevo ensayo terapéutico, eligiendo el intervalo de tiempo que sea mayor.
Prevalencia
En países desarrollados, las cifras de EFR son diferentes en función de la definición de refractariedad empleada, la edad de los pacientes y las fuentes de donde se obtuvieron los datos. En registros hospitalarios y/o consultas más especializadas, un 30-35 % de los pacientes en edad adulta fueron refractarios2,3. En estudios poblacionales donde los pacientes no están tan seleccionados, las cifras son más bajas, con alrededor de un 17-26 % de refractariedad en función de la exigencia de la definición empleada5. En edad pediátrica, alrededor de un 23 % de los niños diagnosticados de epilepsia y seguidos prospectivamente cumplían criterios de farmacorresistencia de acuerdo a la definición de la ILAE6. Nivel de evidencia III.
30-35 % de los pacientes en edad adulta fueron refractarios2,3. En estudios poblacionales donde los pacientes no están tan seleccionados, las cifras son más bajas, con alrededor de un 17-26 % de refractariedad en función de la exigencia de la definición empleada5. En edad pediátrica, alrededor de un 23 % de los niños diagnosticados de epilepsia y seguidos prospectivamente cumplían criterios de farmacorresistencia de acuerdo a la definición de la ILAE6. Nivel de evidencia III.
Factores determinantes en el desarrollo de una epilepsia farmacorresistente
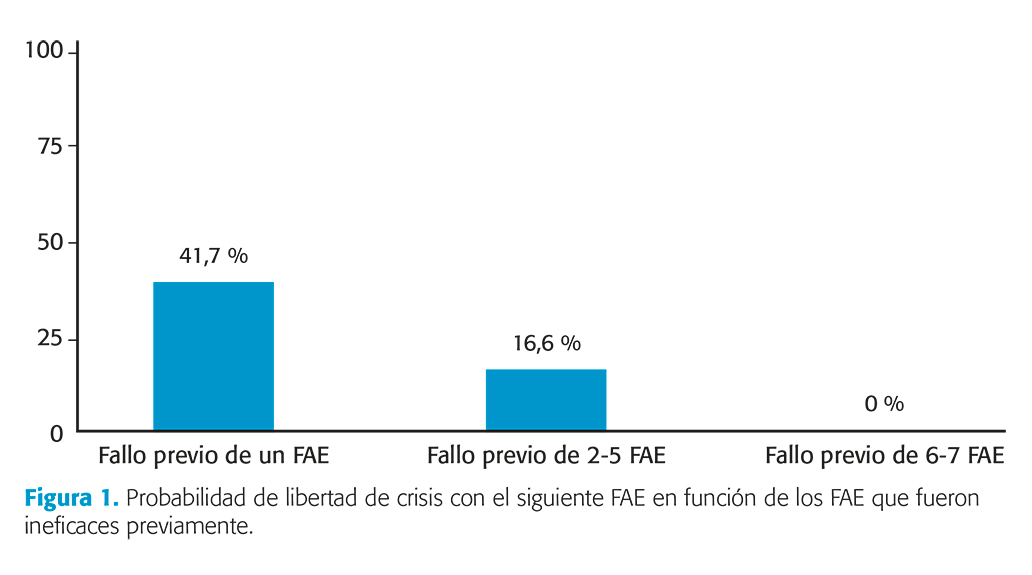
Son múltiples los factores que tienen un valor pronóstico en el desarrollo de una EFR y que cuando son identificados nos deben hacer pensar que existe un mayor riesgo de que ese paciente desarrolle una epilepsia de difícil control. Los principales son la etiología de la epilepsia, el síndrome epiléptico que estamos tratando, la presencia de una lesión epileptogénica en la RM cerebral y la historia farmacológica. Tabla II. Nivel de evidencia I.
Evolución de la respuesta al tratamiento
La farmacorresistencia no es necesariamente evidente desde el principio, especialmente cuando se trata de una epilepsia focal12. Cerca de un 30 % de niños en los que falló un segundo FAC lo hizo al cabo de los 3 años de haber recibido el primer tratamiento13.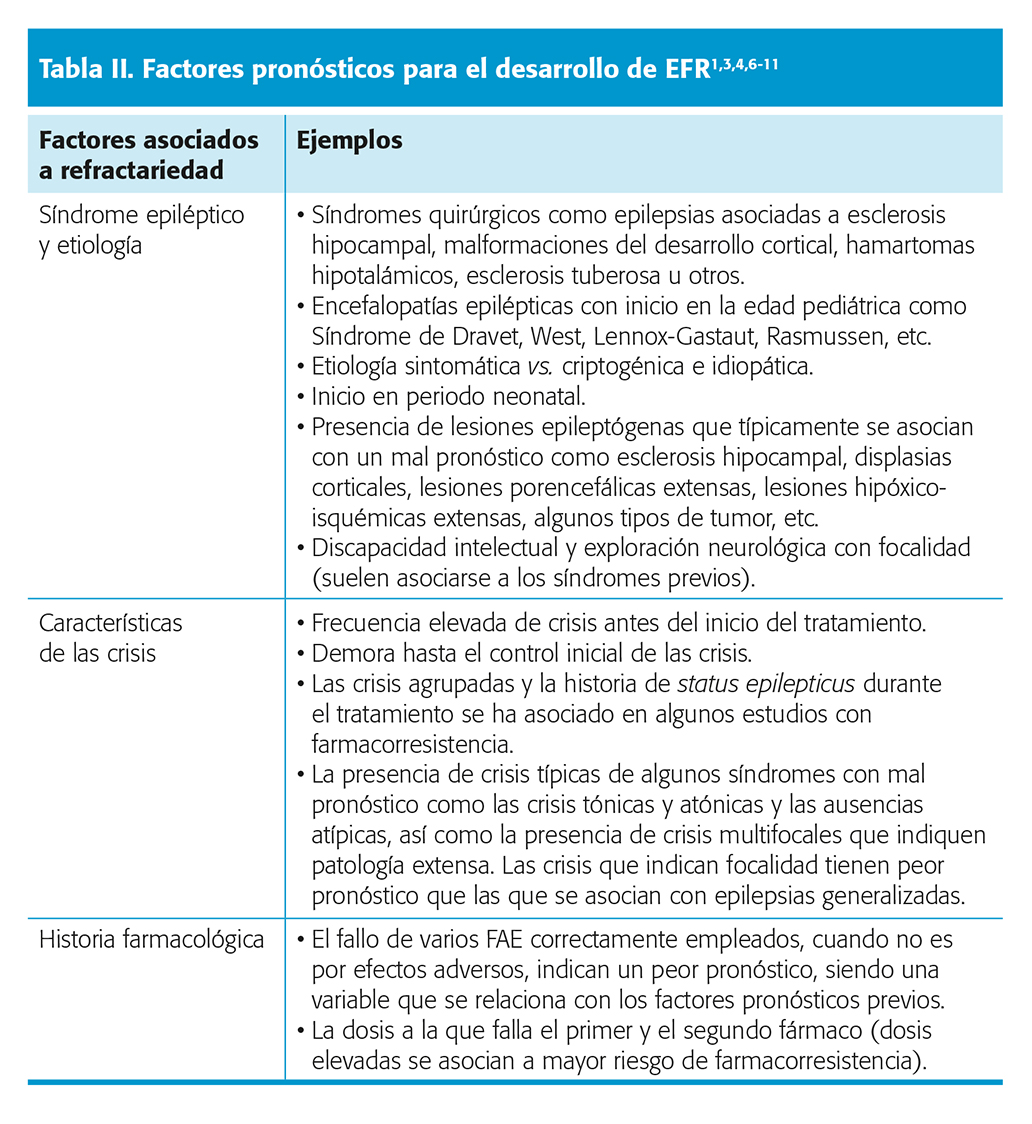 En adultos en los que falló un primer FAC, un 25 % tuvo un segundo fallo de tratamiento al año, subiendo hasta un 45 % a los tres años10. Nivel de evidencia I.
En adultos en los que falló un primer FAC, un 25 % tuvo un segundo fallo de tratamiento al año, subiendo hasta un 45 % a los tres años10. Nivel de evidencia I.
La respuesta al tratamiento farmacológico es dinámica, existiendo diferentes patrones evolutivos:
- Respuesta inicial mantenida en el tiempo.
- Respuesta inicial con evolución posterior hacia farmacorresistencia.
- Respuesta intermitente con periodos de tiempo de diferente duración en los que puede existir una recurrencia de las crisis.
- Farmacorresistencia desde el principio.
La respuesta al tratamiento varía en función de la población del estudio (si se trata de epilepsia de reciente inicio, epilepsia refractaria y cómo de refractaria es) así como de la edad de los pacientes y del diseño del estudio. Nivel de evidencia I. En población adulta con epilepsia de reciente diagnóstico, hasta un 59 % tendrá una respuesta mantenida en el tiempo (un 37 % con respuesta inmediata) y un 25 % no alcanzará un periodo de tiempo mayor a un año libre de crisis. En el resto (16 %), el curso será fluctuante, con periodos de remisión superior al año14. En población adulta con EFR “incidental” (fracasan dos FAC) el pronóstico a largo plazo es peor con hasta un 53 % de pacientes sin un periodo libre de crisis superior al año. Un 31 % se controlará durante el periodo de observación (bien dentro del primer año o posteriormente) y un 16 % tendrá un curso fluctuante11. En población pediátrica con epilepsia de reciente inicio, alrededor de un 95 % tuvo un periodo de control de crisis de al menos un año de duración; aunque un 52 % tuvo recurrencia de crisis en algún momento de su seguimiento, tan sólo un 5 % de los pacientes nunca alcanzó un año completo libre de crisis6. En población pediátrica refractaria, definida como fallo de dos FAC, un 57 % entraron de nuevo en remisión (más de un año sin crisis), si bien la respuesta fue transitoria y tan sólo un 23 % estaba sin crisis en los tres últimos años de seguimiento15.
¿Qué podemos esperar de los nuevos FAC en pacientes con EFR?
Hasta hace algunos años, a pesar de la incorporación de nuevos FAC, la respuesta al tratamiento farmacológico no había mejorado de forma significativa. Un estudio de referencia publicado en 2018 mostró que, en pacientes con epilepsia de reciente inicio seguidos durante décadas, un 63,7 % se encontraba controlado en el último año de seguimiento. Este resultado fue muy similar al observado 16 años antes por los mismos autores (64 % libres de crisis)2,3 cuando se disponía de menos opciones terapéuticas. En este trabajo, un 50,5 % logró el control de crisis con el primer FAC. Sin embargo, si este primer FAC fallaba, un segundo FAC solo conseguía el control en el 11,6 % de los casos, reduciéndose la probabilidad al 4,1 % con un tercer FAC. A partir de ahí, la posibilidad de alcanzar libertad de crisis con cada nuevo fármaco adicional era solo del 1 %. Nivel de evidencia III. Un subanálisis de esta cohorte16 mostró que la respuesta en adolescentes era similar: un 67 % estaba libre de crisis en el último año (mejor respuesta en pacientes con epilepsia generalizada que focal, 72 % vs. 60 % libres de crisis). Otro estudio cuantificó la respuesta en función de los ensayos terapéuticos fallidos previos4 (fig. 1). En él se observó que por cada 1,5 FAC que el paciente había probado sin éxito, la probabilidad de controlarse con el siguiente intento se reducía en un 50 %. Nivel de evidencia III.
En los últimos 5 años se han incorporado nuevos FAC que están mejorando de forma notable la respuesta al tratamiento, especialmente en epilepsia focal17. En este sentido, el cenobamato (CNB) ha demostrado una tasa de libertad de crisis del 21 % en un ensayo clínico en pacientes con epilepsia focal farmacorresistente18, una eficacia muy superior a la de otros FAC evaluados en las últimas dos décadas (21 % de libertad de crisis con 400 mg frente a menos del 7 % con otros fármacos). Estos resultados se han replicado en estudios observacionales y podrían ser incluso mejores si el CNB se utiliza de forma más temprana, por ejemplo, tras el fracaso de dos FAC.
Actualmente, estamos asistiendo a un cambio de paradigma en el tratamiento de la epilepsia. Los ensayos clínicos y los nuevos fármacos aprobados están dirigidos a patologías cada vez más específicas, incluidos pacientes pediátricos17. En esta línea, la fenfluramina ha sido aprobada para tratar los síndromes de Dravet y Lennox-Gastaut. En un ensayo clínico19, la fenfluramina (FFA) (0,7 mg/kg/día) logró reducir la frecuencia de crisis convulsivas en un 55,7 % frente a placebo, con un 8 % de pacientes completamente libres de crisis frente a ninguno en el grupo placebo. Por su parte, el cannabidiol (CBD) también ha sido aprobado para los síndromes de Dravet, Lennox-Gastaut y la epilepsia asociada a esclerosis tuberosa, mostrando una mejora significativa en la tasa de respondedores, con una reducción de aproximadamente el 30-40 % de las crisis respecto a placebo20,21.
¿Qué aporta el cambio de tratamiento en los pacientes con EFR establecida?
En pacientes con EFR establecida, cambios secuenciales en el tratamiento con FAC pueden lograr el control de las crisis en un subgrupo de pacientes. En población pediátrica donde habían fallado dos FAC (EFR incidental), un 80 % permanecerá sin crisis durante un año y uno de cada dos pacientes más de 5 años 22. Nivel de evidencia III. No obstante, el tiempo hasta alcanzar un periodo prolongado de remisión no necesariamente es inmediato y puede llevar varios años de cambios secuenciales de tratamiento. Además, la remisión no siempre se mantiene en el tiempo, existiendo una recaída de hasta el 68 % de los niños con EFR que llegaron a alcanzar un año sin crisis15. En adultos con EFR de larga duración, alrededor de un 3-5 % de pacientes al año conseguirán un periodo libre de crisis superior al año durante el periodo de seguimiento23,24; aunque muchos de ellos tendrán recaídas (alrededor del 71-80 %), la frecuencia/intensidad de las crisis durante dicho periodo puede ser muy inferior al del previo19. Nivel de evidencia III.
Queda por definir si los nuevos FAC que se acaban de incorporar podrán cambiar este escenario. Aunque no hay ensayos clínicos, estudios observacionales con CNB muestran que este fármaco puede seguir siendo eficaz y “rescatar” a pacientes que recibieron tratamiento previo con multitud de FAC (pacientes “superrefractarios”), con una libertad de crisis de hasta el 14 % a los 12 meses, permitiendo también la reducción de la carga total de FAC que recibían25. Igualmente, debido a la alta eficacia observada con CNB en la vida real, algunos autores sugieren usar este fármaco previamente o en paralelo a una posible evaluación prequirúrgica26.
Por ello, en los pacientes con EFR crónica, donde no existen opciones de tratamiento quirúrgico o este es arriesgado, debe intentarse tratamiento con diferentes FAC, empleando una politerapia racional.
Causas que simulan farmacorresistencia
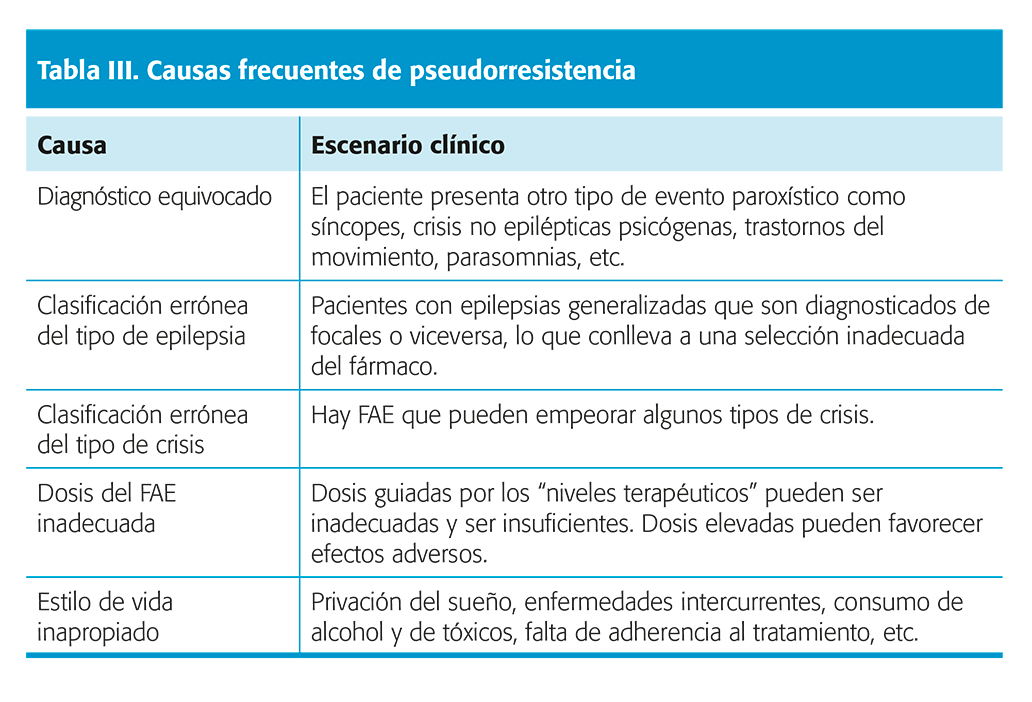
Antes de diagnosticar a un paciente de EFR se debe descartar que realmente presenta una pseudorresistencia. Este concepto hace referencia a la persistencia de las crisis/episodios paroxísticos debido a un diagnóstico y/o manejo terapéutico inadecuado. Tabla III.
Actitud ante una epilepsia farmacoresistente
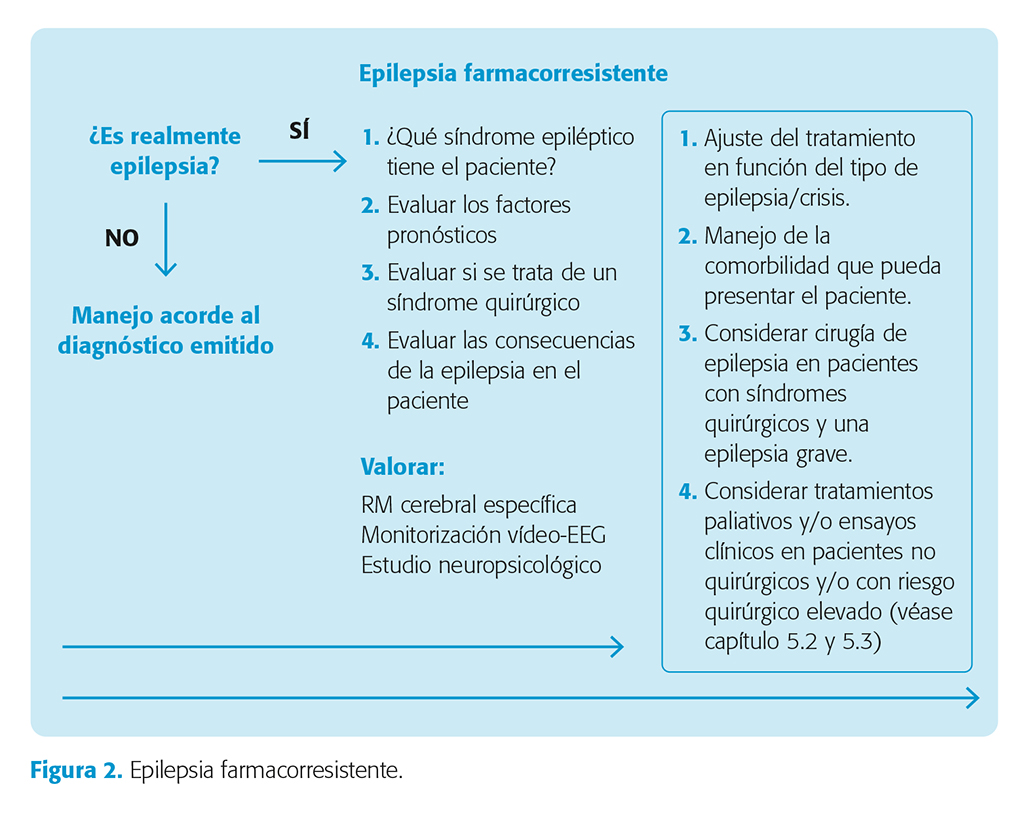
Los pacientes con diagnóstico de EFR deben ser evaluados por un epileptólogo en una Unidad de Epilepsia. La figura 2 muestra un algoritmo de manejo.
POLITERAPIA RACIONAL
Introducción
La politerapia racional (PR) hace referencia a la combinación de varios FAC con el objetivo de potenciar su eficacia, siendo la eficacia de la combinación superior a la esperada por la suma individual de la eficacia de cada fármaco (supraaditiva). No obstante, al igual que se puede sumar o multiplicar la eficacia, también ocurre lo mismo con los efectos adversos (EA). Los escenarios clínicos hipotéticos que se pueden dar al combinar dos FAC en cuanto a la eficacia obtenida y a los efectos adversos los podemos ver en la tabla IV.
¿Está justificada la politerapia con FAC con diferente mecanismo de acción?
Basándose en estudios en modelos animales, es conocido que a nivel preclínico, son múltiples las combinaciones de FAC que han mostrado mayor eficacia cuando se dan juntas, si bien a nivel clínico sigue siendo controvertido. Nivel de evidencia III. El diseño de los ensayos clínicos actuales es válido para demostrar que el FAC añadido es superior al placebo, pero no demuestra necesariamente que exista un sinergismo real. No obstante, de forma indirecta, algunos estudios muestran que determinadas combinaciones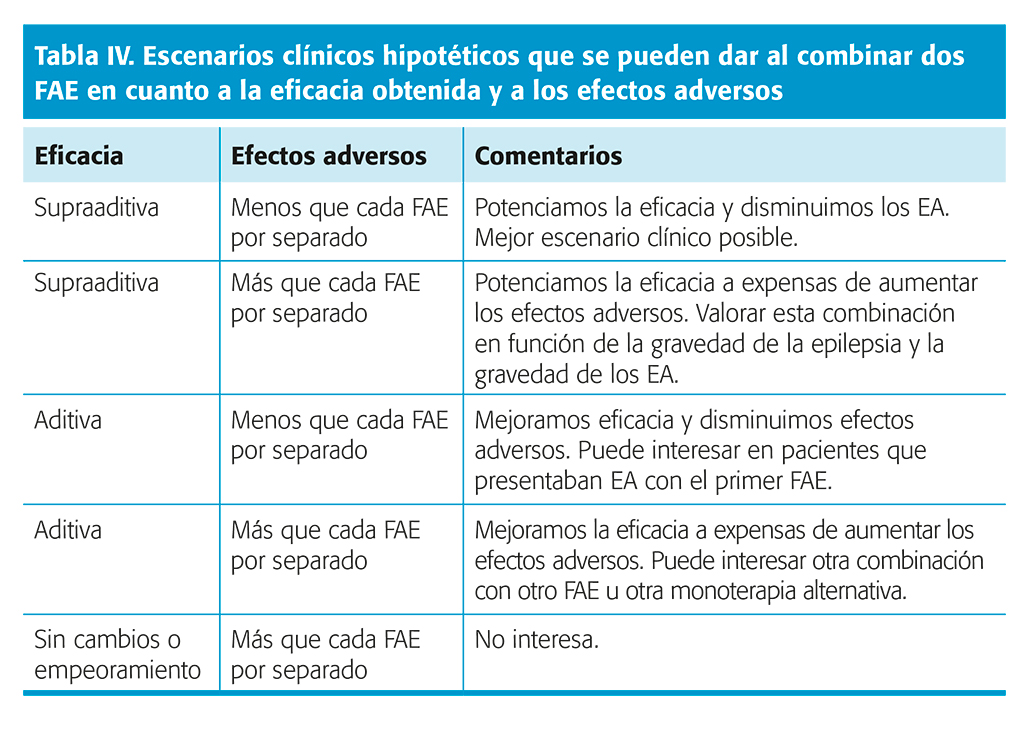 pueden ser superiores a otras; un estudio observacional mostró que los pacientes que fueron tratados con combinaciones de FAC con diferente mecanismo de acción (MA) tenían más posibilidad de mantener el tratamiento en el tiempo y de usar menos recursos sanitarios27. Nivel de evidencia III. De las combinaciones posibles, la asociación de ácido valproico junto con la lamotrigina es la que más se acerca al concepto de PR28.
pueden ser superiores a otras; un estudio observacional mostró que los pacientes que fueron tratados con combinaciones de FAC con diferente mecanismo de acción (MA) tenían más posibilidad de mantener el tratamiento en el tiempo y de usar menos recursos sanitarios27. Nivel de evidencia III. De las combinaciones posibles, la asociación de ácido valproico junto con la lamotrigina es la que más se acerca al concepto de PR28.
Consideraciones a tener en cuenta cuando empleamos politerapia (tabla V)
Aunque la evidencia sobre la PR es escasa, las combinaciones que hagamos con los distintos FAC se guiará por las siguientes directrices:
- Emplearemos combinaciones de FAC que sean apropiados para el síndrome epiléptico que estamos tratando. Evitaremos FAC que pueden empeorar algunos tipos de crisis epilépticas en aquellos síndromes que tengan varios tipos de crisis.
- Emplearemos FAC que se complementen y que cubran todos los tipos de crisis que tenga el paciente (por ejemplo: un FAC que cubra las CGTC y otro las mioclonías).
- Emplearemos FAC con diferente MA. El riesgo de toxicidad es mayor cuando empleamos FAC con el mismo MA27.
- Evitaremos combinar FAC que tengan un pEFRil de EA similar al aumentar el riesgo de toxicidad (por ejemplo: si los dos FAC son sedantes, aumentará la somnolencia del paciente).
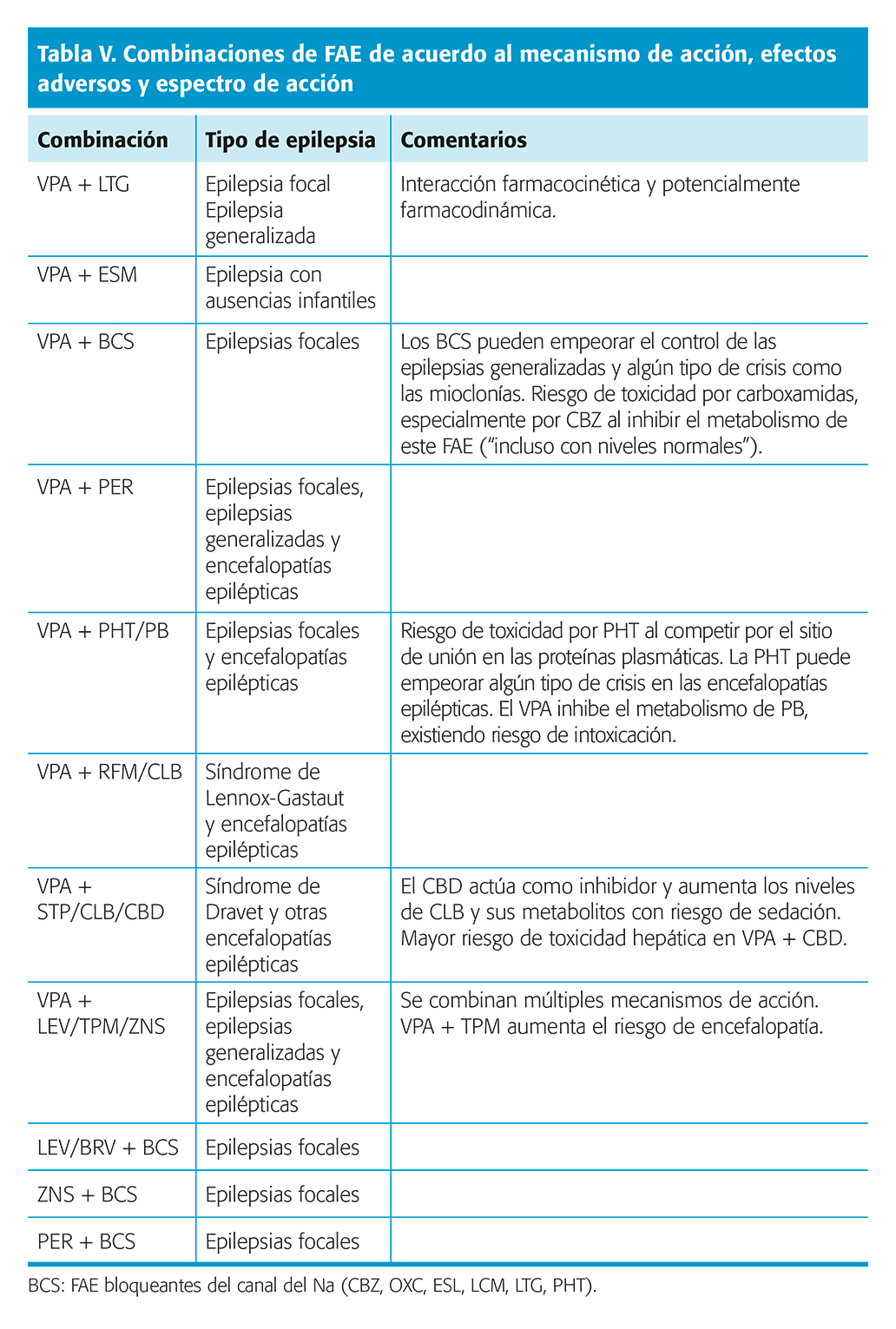
- Se deben buscar combinaciones de FAC con un pEFRil de EA contrapuesto (por ejemplo: si un paciente toma VPA, buscaremos otro FAC que disminuya el peso).
- Emplearemos en número mínimo de FAC posibles. Combinaciones con más de tres FAC no suelen mejorar el control y aumentan sustancialmente los EA3,28.
- Ajustaremos la dosis total en función de los FAC que asociemos (dosis altas no suelen ser superiores a dosis medias o bajas)28.
- Elegiremos los FAC de acuerdo a las características del paciente y de los fármacos que pudiera estar tomando.
- Tendremos en cuanta las posibles interacciones farmacocinéticas y farmacodinámicas entre los diferentes FAC (véase capítulo 2.1).
- Interacciones farmacocinéticas: tienen una repercusión directa sobre la concentración plasmática de los FAC en el individuo (son “medibles” a través de los niveles en los FAC más antiguos) y se deben al efecto/interacción que tiene un FAC sobre otro en su absorción, distribución, metabolismo y/o eliminación.
- Interacciones farmacodinámicas: se deben al efecto que tiene un FAC sobre otro a nivel celular, en la diana donde ejercen su MA. No son medibles y, por lo tanto, no dependen de los niveles séricos de los FAC. En teoría justificarían la combinación de los FAC basándose en el MA, dentro de una posible PR. Cuando combinamos dos FAC con el mismo MA es más probable tener EA aún con niveles de los FAC “en rango” o “subterapéuticos”.

Bibliografía
- Kwan P, Arzimanoglou A, Berg AT, Brodie MJ, Allen Hauser W, Mathern G, et al. Definition of drug resistant epilepsy: consensus proposal by the ad hoc Task Force of the ILAE Commission on Therapeutic Epilepsia 2010; 51:1069-77.
- Kwan P, Brodie MJ. Early identification of refractory epilepsy. N Engl J Med. 2000; 342: 314-9.
- Chen Z, Brodie MJ, Liew D, Kwan P. Treatment outcomes in patients with newly diagnosed epilepsy treated with established and new antiepileptic drugs: A 30-Year Longitudinal Cohort JAMA Neurol. 2018; 75: 279-86.
- Schiller Y, Najjar Y. Quantifying the response to antiepileptic drugs: effect of past treatment Neurology. 2008; 70: 54-65.
- Picot MC, Baldy-Moulinier M, Daurès JP, Dujols P, Crespel The prevalence of epilepsy and pharmacoresistant epilepsy in adults: a population-based study in a Western European country. Epilepsia. 2008; 49: 1230-8.
- Berg AT, Rychlik K. The course of childhood-onset epilepsy over the first two decades: A prospective, longitudinal Epilepsia. 2015; 56: 40-8.
- Sillanpää M, Schmidt D. Early seizure frequency and aetiology predict long-term medical outcome in childhood-onset Brain. 2009; 132: 989-98.
- Sillanpää M, Schmidt D. Seizure clustering during drug treatment affects seizure outcome and mortality of childhood-onset Brain. 2008; 131: 938-44.
- Brodie MJ, Barry SJE, Bamagous GA, Kwan P. Effect of dosage failed of first antiepileptic drug on subsequent Epilepsia. 2013; 54: 194-8.
- Bonnett LJ, Tudur C, Donegan S, Marson AG. Treatment outcome after failure of a first antiepileptic Neurology. 2014; 83: 552-60.
- Hughes DM, Bonnett LJ, Czanner G, Komárek A, Marson AG, García-Fiñana M. Identification of patients who will not achieve seizure remission within 5 years on Neurology. 2018; 91: e2035-44.
- Choi H, Hayat MJ, Zhang R, Hirsch LJ, Bazil C, Mendiratta A, et al. Drug-resistant epilepsy in adults: Outcome trajectories after failure of two medications. Epilepsia. 2016; 57: 1152-60.
- Berg AT, Vickrey BG, Testa FM, Levy SR, Shinnar S, DiMario F, et al. How long does it take for epilepsy to become intractable? A prospective investigation. Ann neurol. 2006; 60: 73-9.
- Brodie MJ, Barry SJ, Bamagous GA, Norrie JD, Kwan P. Patterns of treatment response in newly diagnosed Neurology. 2012; 78: 1548-54.
- Berg AT, Levy SR, Testa FM, D’Souza R. Remission of epilepsy after two drug failures in children: A prospective Ann Neurol. 2009; 65: 510-9.
- Alsfouk BA, Alsfouk AA, Chen Z, Kwan P, Brodie MJ. Pharmacological outcomes in teenagers with newly diagnosed epilepsy: a 30-year cohort study. Epilepsia. 2019; 60: 1083-90.
- Klein P, Friedman D, Kwan P. Recent advances in pharmacologic treatments of dru-gresistant epilepsy: breakthrough in sight. CNS Drugs. 2024; 38: 949-60. .
- Krauss GL, Klein P, Brandt C, Lee SK, Milanov I, Milovanovic M, et al. Safety and effica-cy of adjunctive cenobamate (YKP3089) in patients with uncontrolled focal seizures: a mul-ticentre, double-blind, randomised, placebo-controlled, doseresponse trial. Lancet Neu-rol. 2020; 19: 38-48.
- Lagae L, Sullivan J, Knupp K, Laux L, Polster T, Nikanorova M, et al. Fenfluramine hy-drochloride for the treatment of seizures in Dravet syndrome: a randomised, double-blind, placebo-controlled trial. Lancet. 2019; 394: 2243-54.
- Thiele EA, Bebin EM, Bhathal H, Jansen FE, Kotulska K, Lawson JA, et al. Add-on can-nabidiol treatment for drug-resistant seizures in tuberous sclerosis complex: a placebo-controlled randomized clinical trial. JAMA Neurol. 2021; 78: 285-92.
- Miller I, Scheffer IE, Gunning B, Sánchez-Carpintero R, Gil-Nagel A, Scott Perry M, et al. Dose-ranging effect of adjunctive oral cannabidiol vs placebo on convulsive seizure fre-quency in dravet syndrome: a randomized clinical trial. JAMA Neurol. 2020; 77: 613-21.
- Sillanpää M, Schmidt D. Is incident drug-resistance of childhood-onset epilepsy reversible? A long-term follow-up Brain. 2012; 135: 2256-62.
- Callaghan B, Schlesinger M, Rodemer W, Pollard J, Hesdorffer D, Allen Hauser W, et al. Remission and relapse in a drug-resistant epilepsy population followed prospectively. 2011; 52: 619-26.
- Choi H, Heiman GA, Munger Clary H, Etienne M, Resor SR, Hauser WA. Seizure remission in adults with long-standing intractable epilepsy: an extended follow-up. Epilepsy 2011; 93: 115-9.
- Roberti R, Assenza G, Bisulli F, Boero G, Canafoglia L, Chiesa V, et al. Adjunctive cenobamate in people with focal onset seizures: Insights from the Italian Expanded Access Program. Epilepsia. 2024; 65: 2909-22.
- Laxer KD, Elder CJ, Di Gennaro G, Ferrari L, Krauss GL, Pellinen J, et al. Presurgical use of cenobamate for adult and pediatric patients referred for epilepsy surgery: expert panel recommendations. Neurol Ther. 2024; 13: 1337-48.
- Margolis JM, Chu BC, Wang ZJ, Copher R, Cavazos JE. Investigation off effectiveness of antiepileptic drug combination therapy for partial-onset seizures based on mechanisms of JAMA Neurol. 2014; 71: 985-93.
- Poolos NP, Castagna CE, Williams S, Miller AB, Story TJ. Association between antiepileptic drug dose and long-term response in patients with refractory epilepsy. Epilepsy 2017; 69: 59-68.


