INTRODUCCIÓN
En torno al 70 % de los pacientes con epilepsia consiguen una remisión mantenida tras el inicio del tratamiento con FAE43. Sobre las dos terceras partes de los pacientes tratados quirúrgicamente por resistencia a FAE, alcanzan el control de las CE tras la cirugía44. En los pacientes con una remisión prolongada de las CE, no existe ningún indicador absoluto que determine si la ausencia de CE es debida al tratamiento con FAE o a una remisión total de la epilepsia. Por tanto, existe el dilema sobre si los FAE deben ser retirados, al desconocerse la probabilidad de tener nuevas CE en ausencia de medicación. No obstante, la supresión de FAE constituye una opción razonable en pacientes en remisión prolongada de CE, si bien debe ser individualizada tras evaluar los beneficios físicos, cognitivos, psicológicos y económicos de la retirada de FAE y los riesgos de recaída de CE tras la supresión de FAE y analizar los factores de predicción de recurrencia de CE.
SUPRESIÓN DEL TRATAMIENTO ANTIEPILÉPTICO EN PACIENTES EN REMISIÓN
Tiempo de espera libre de CE para la supresión del tratamiento
En un ECA prospectivo y multicéntrico, sobre la continuidad versus retirada de FAE, con 1.013 pacientes, niños y adultos, que habían estado libres de CE durante al menos dos años, se obtuvo un riesgo de recurrencia de las CE del 22 % de los pacientes en los que se mantuvo el tratamiento y del 41 % en los que se retiró, o sea, uno de cada 5 pacientes a los que se suspendió el tratamiento tuvo una recurrencia relacionada con la retirada de FAE45. En otro ECA prospectivo y cegado, con 160 adultos libres de CE al menos dos años con un solo FAE, el riesgo de recaída de CE a los 12 meses fue del 7 % en el grupo que continuó con el FAE, y del 15 % del grupo que lo suspendió, sin significación estadística. Los criterios de inclusión fueron restrictivos, seleccionándose mucho a los pacientes (se excluyó a pacientes con epilepsia mioclónica juvenil, con EEG anormal y con retraso mental, entre otros). También se constató una mejoría significativa en el estado cognitivo en los pacientes que suspendieron el FAE con relación a los que lo mantuvieron46. Nivel de evidencia I.
En una RS con metanálisis de 45 artículos con 7.082 pacientes, niños y adultos, a los que se le retiró FAE tras un periodo libre de CE superior a dos años, salvo en 4 estudios que dicho periodo de remisión fue inferior a los dos años, el riesgo de recaída de CE tras la supresión, fue del 22 % al año de la retirada, del 28 % a los dos años, y del 34 % a los cuatro años47. Nivel de evidencia II.
En otra RS sobre retirada de FAE en pacientes libres de CE, de forma temprana (- de 2 años) versus tardía (+ de 2 años), se encontraron evidencias en niños que respaldan la espera mínima de al menos dos años sin CE antes de suprimir los FAE. Por el contrario, no se detectaron pruebas sobre el momento óptimo de retirada de FAE en adultos sin CE48. En dicha RS, se constató que de cada 8 pacientes menores de 16 años con epilepsia en remisión a los que se le suprimió FAE, 1 tuvo recurrencia de CE48. Nivel de evidencia I.
En la mayoría de los estudios, el tiempo de remisión de dos años prerretirada fue seleccionado de una forma artificiosa, comprobándose que por cada año de espera libre de CE se reduce el riesgo de recaída tras la suspensión del tratamiento47. Nivel de evidencia II.
Factores de predicción de recurrencia de CE tras supresión del tratamiento
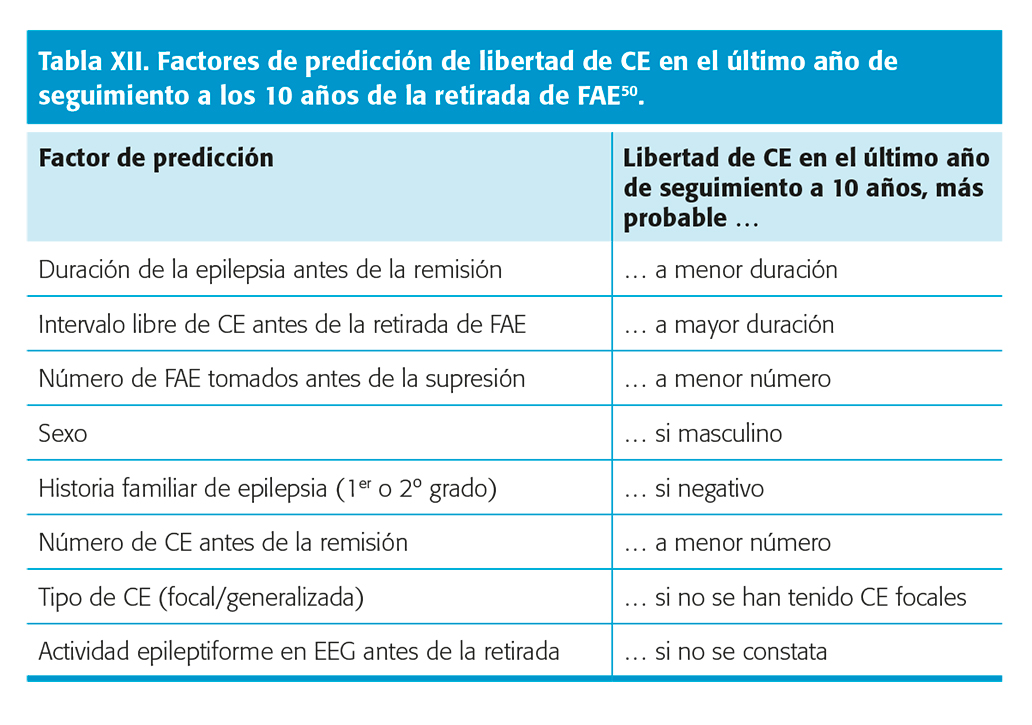
En una RS con metanálisis, en 10 estudios con buena calidad metodológica con 1.769 niños y adultos, se evidenciaron los factores de predicción más importantes de recurrencia de CE y los de evolución a largo plazo tras la retirada de FAE, que se reflejan en las tablas XI y XII49. Nivel de evidencia I. Con estos factores de predicción, se confeccionó un nomograma de cálculo de riesgo de recurrencia a los 2 y 5 años y la probabilidad de permanecer libre de CE en último año de seguimiento a los 10 años de la supresión, accesible de forma abierta en la web, que es muy útil como herramienta de trabajo50.
En cuanto al EEG prerretirada de FAE, en un metanálisis de 15 estudios con 2.349 pacientes, un EEG anormal predijo de forma significada la recurrencia de CE51. No obstante, la presencia de actividad epileptiforme antes de la supresión de FAE, aunque incremente el riesgo de recidiva de CE, no debe modificar el criterio de una posible retirada en un paciente con ausencia o baja presencia de otros factores de predicción49. Nivel de evidencia III.
Riesgos de la supresión del tratamiento antiepiléptico crónico
Los riesgos de la supresión de FAE tras un periodo de remisión prolongada son la recaída de CE con sus aspectos negativos, tales como lesiones físicas, estado epiléptico e incluso la muerte, similares a los considerados en el inicio de un tratamiento antiepiléptico en primera instancia. Nivel de evidencia I. También deben considerarse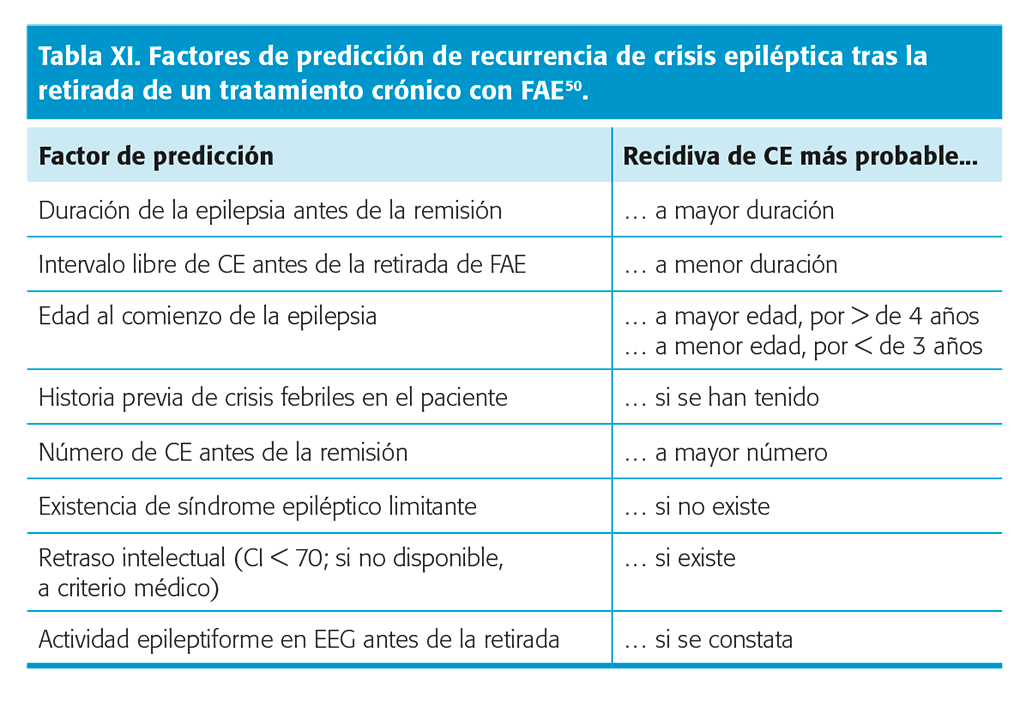
 los efectos negativos de la posible recaída en el estado emocional, psíquico, social y laboral, y el riesgo de perder la licencia de conducción o el empleo, que pueden ser determinantes en algunos adultos.
los efectos negativos de la posible recaída en el estado emocional, psíquico, social y laboral, y el riesgo de perder la licencia de conducción o el empleo, que pueden ser determinantes en algunos adultos.
Un aspecto relevante es la posibilidad de no alcanzarse una nueva remisión de las CE, como la existente antes de retirarse el FAE, tras la reintroducción del mismo. En la RS con metanálisis citada49, 136 pacientes de 1.455 (9 %) no estuvieron libres de CE en el último año de seguimiento a largo plazo, por lo que la reintroducción de FAE falló en alcanzar una remisión como la previa a la retirada en 1/10 pacientes. Este hecho ha sido detectado por otros con hasta un 23 % de transformación de epilepsia controlada en resistente a FAE, tras la retirada de FAE y posterior reintroducción52. Nivel de evidencia III. Aunque no existen pruebas de la causalidad directa entre la retirada de FAE y subsiguiente descontrol de la epilepsia, este riesgo debe tenerse presente y se debe informar al paciente o familiares antes de la retirada de FAE.
Duración de la reducción de FAE hasta la supresión
Los periodos de reducción de FAE usados en los diferentes estudios son muy variables (cuatro semanas a varios años). En un ECA no cegado, en 216 niños se comparó la retirada en un periodo de 4-6 semanas con la retirada en 4-6 meses y no se encontraron diferencias significativas53. En el ECA prospectivo cegado, que incluyó 160 adultos se redujo la dosis del FAE en un 20 % de la dosis inicial en las primeras 6 semanas con reducción posterior de un 20 % de la dosis inicial cada dos semanas para suspender totalmente en 12 semanas46. El riesgo de recurrencia de CE en reducción muy lenta es similar con respecto a tiempos de retirada de uno a seis meses. Nivel de evidencia III.
Muchos clínicos opinan que la retirada de barbitúricos y benzodiacepinas debe ser más lenta (al menos 6 meses) porque podrían producirse CE por abstinencia de estos FAE, si bien esto no ha sido demostrado de forma categórica.
SUPRESIÓN DEL TRATAMIENTO ANTIEPILÉPTICO TRAS CIRUGÍA DE EPILEPSIA
Tiempo de espera libre de CE para la reducción-supresión del tratamiento
En un ensayo clínico prospectivo sobre continuidad versus retirada de FAE en pacientes que alcanzaron una remisión de las CE tras 1 año de la cirugía, se observó que presentaron CE 73 de 162 pacientes (45 %) a los que no se redujo FAE y 41 de 129 (32 %) a los que se redujo de dos FAE a uno o de un FAE a ninguno, no encontrándose diferencias significativas54. En otro estudio comparativo, prospectivo y controlado, con 60 pacientes a los que se retiró FAE un año después de la cirugía, 26 de 34 (76,5 %) pacientes del grupo de retirada y 16 de 26 (61,5 %) pacientes en el grupo sin retirada, permanecieron sin CE cinco años tras de la cirugía55. En una RS con metanálisis que incluyó 16 artículos con 1.456 pacientes (niños y adultos) a los que se les redujo el tratamiento tras cirugía de resección y 685 a los que no se les redujo, tras un periodo mínimo de un año tras la cirugía, el riesgo de recurrencia promedio de CE fue del 18 % (rango: 0-55 %). La tasa de recaída de CE en pacientes con reducción de FAE fue más baja que en los pacientes sin cambios de tratamiento después de la cirugía (OR 0,39, CI 95 % 0,300-0,507, p > 0,001). Nivel de evidencia III. Estos datos sugieren un elevado sesgo de selección de los pacientes a los que se les redujo los FAE, al no ser aleatorizados los estudios. Un 90 % de los casos incluidos en la RS con metanálisis eran de resección del lóbulo temporal, con lesión focal en la RM (85 %), resección quirúrgica completa (81 %) y no se diferenciaba entre disminución y retirada total de FAE tras la cirugía56.
En otra RS con metanálisis de 16 artículos con 2.441 pacientes tratados con cirugía, niños y adultos, a los que se le retiró FAE tras un periodo libre de CE superior a un año, el riesgo acumulado de recurrencia de CE tras la retirada de FAE, fue del 13,7 % al año de la retirada, del 21 % a los 2 años, del 24,1 % a los 3-4 años y del 28,5 % a los 5 años o más47. Nivel de evidencia III.
Factores de predicción de recurrencia de CE tras supresión del tratamiento
No son bien conocidos en la actualidad, puesto que los estudios existentes muestran resultados contradictorios por su baja-moderada calidad, como queda reflejado en las RS comentadas previamente47,56. En los distintos estudios se mencionan factores predictivos de poca consistencia por el sesgo de selección. En estos estudios, realizados sobre todo con pacientes adultos56,57, han sido descritos como factores predictivos más habituales los que se reflejan en la tabla XIII. Nivel de evidencia III. En la tabla XIV consta el perfil del candidato ideal para la reducción-supresión de FAE después de la cirugía con éxito y remisión de CE56. Nivel de evidencia III.
Riesgos de la supresión del tratamiento crónico tras cirugía de epilepsia
La gran mayoría de los pacientes sometidos a cirugía de epilepsia están con tratamientos complejos de varios FAE, que tienen consecuencias de todo tipo, sobre todo cognitivas, por lo que los beneficios de la reducción-supresión de FAE son destacados en cuanto a la supresión o disminución de efectos secundarios. En estos pacientes, la reducción de FAE tras comprobar que se controlan las CE tras la cirugía es la norma, aun asumiendo la reaparición de las mismas con sus posibles consecuencias.
Existe también la posibilidad de no conseguirse una nueva remisión tras recidiva de las CE como antes de reducirse o suprimirse los FAE. En el ensayo clínico ya citado54, alrededor de un tercio de los pacientes libres de CE después de la cirugía experi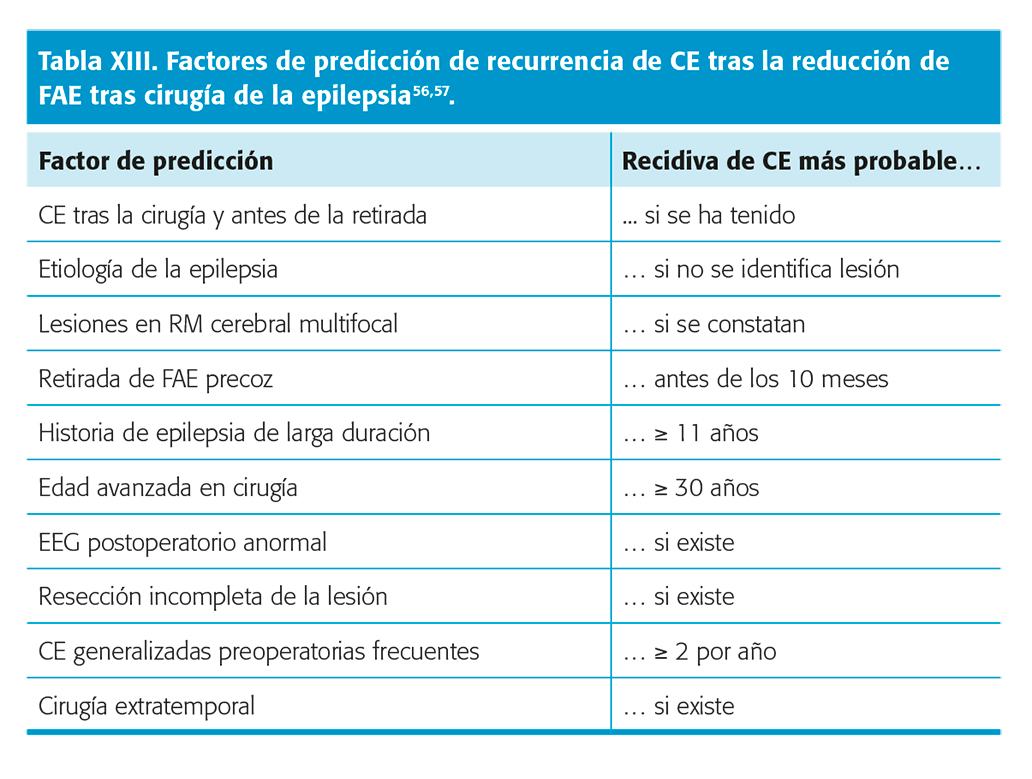
 mentaron una recaída después del intento de reducir tratamiento y, de éstos, en una tercera parte la reintroducción del FAE falló en alcanzar la remisión como la previa a la retirada. En el otro ensayo clínico prospectivo55, de los pacientes que presentaron reaparición de CE tras la reducción-supresión del FAE, en un tercio de ellos la reintroducción de FAE no alcanzó la remisión como la previa a la retirada de FAE tras la cirugía. Nivel de evidencia III.
mentaron una recaída después del intento de reducir tratamiento y, de éstos, en una tercera parte la reintroducción del FAE falló en alcanzar la remisión como la previa a la retirada. En el otro ensayo clínico prospectivo55, de los pacientes que presentaron reaparición de CE tras la reducción-supresión del FAE, en un tercio de ellos la reintroducción de FAE no alcanzó la remisión como la previa a la retirada de FAE tras la cirugía. Nivel de evidencia III.
Duración de la reducción de FAE hasta la supresión
En la RS con metanálisis previamente citada56, a los pacientes que se les redujo la medicación por control de CE tras cirugía de epilepsia, los FAE se reducían utilizando un programa individualizado para cada paciente. En sólo ocho estudios, se describió un protocolo específico para la reducción de FAE; el intervalo medio entre la cirugía y el comienzo de reducción de FAE fue de 14 meses; el tiempo medio para lograr la retirada fue de 30 meses. En general, se describen tres principios con respecto a la reducción: en los pacientes que tomaban varios FAE, cada uno se redujo individualmente por completo antes de comenzar a reducir el segundo y la reducción de dosis se realizó en pequeños pasos cada 2-3 meses. La reducción de FAE en pacientes en remisión de CE tras cirugía se realiza de forma individualizada y escalonada, entre varios meses a dos-tres años. Nivel de evidencia IV.
¿QUIÉN DEBE TOMAR LA DECISIÓN DE SUPRESIÓN DEL TRATAMIENTO ANTIEPILÉPTICO CRÓNICO?
La decisión de suprimir el tratamiento crónico, tanto en pacientes controlados medicamente como tras cirugía de epilepsia, debe ser consensuada entre el médico responsable y conocedor del caso, en conjunción con el paciente y/o sus familiares, después de aportarles toda la información sobre los beneficios y riesgos de la retirada, así como la probabilidad de recurrencia de CE y de la posibilidad existente de no alcanzarse de nuevo la remisión tras la reintroducción de FAE en caso de recidiva de CE.

Bibliografía
- Shorvon SD, Goodridge DM. Longitudinal cohort studies of the prognosis of epilepsy: contribution of the National General Practice Study of Epilepsy and other studies. 2013; 136: 3497-510. doi: 10.1093/ brain/awt223.
- West S, Nolan SJ, Cotton J, Gandhi S, Weston J, Sudan A, et al. Surgery for epilepsy. Cochrane Database Syst Rev. 2015; (7): CD010541. doi: 10.1002/ 14651858. pub2.
- Randomised study of antiepileptic drug withdrawal in patients in remission. Medical Research Council Antiepileptic Drug Withdrawal Study Group. Lancet. 1991; 337: 1175-80. doi: 1016/s0140-6736 (91)92856-w.
- Lossius MI, Hessen E, Mowinckel P, Stavem K, Erikssen J, Gulbrandsen P, et al. Consequences of antiepileptic drug withdrawal: a randomized, double-blind study (Akershus Study). Epilepsia. 2008; 49: 455-63. doi: 10.1111/j.1528- 2007.01323.x.
- Lamberink HJ, Otte WM, Geleijns K, Braun KP. Antiepileptic drug withdrawal in medically and surgically treated patients: a meta-analysis of seizure recurrence and systematic review of its Epileptic Disord. 2015; 17: 211-28. doi: 10.1684/ epd.2015.0764.
- Strozzi I, Nolan SJ, Sperling MR, Wingerchuk DM, Sirven Early versus late antiepileptic drug withdrawal for people with epilepsy in remission. Cochrane Database Syst Rev 2015; (2): CD001902. doi: 10.1002/14651858. CD001902.pub2.
- Lamberink HJ, Otte WM, Geerts AT, Pavlovic M, Ramos-Lizana J, Marson AG, et al. Individualised prediction model of seizure recurrence and long-term outcomes after withdrawal of antiepileptic drugs in seizure-free patients: a systematic review and individual participant data meta-analysis. Lancet Neurol. 2017; 16: 523-31. doi: 1016/S1474-4422 (17)30114-X.
- AED withdrawl risk Disponible en: http://epilepsypredictiontools.info withdrawal [última visita el 1-julio-2019].
- Tang L, Xiao Z. Can electroencephalograms provide guidance for the withdrawal of antiepileptic drugs: a meta-analysis. Clin Neurophysiol. 2017; 128: 297-302. doi: 1016/j.clinph. 2016.11.024.
- Schmidt D, Sillanpää M. Stopping epilepsy treatment in seizure remission: good or bad or both? 2017; 44: 157-61. doi: 10.1016/j.seizure. 2016.09.003.
- Ramos-Lizana J, Aguirre-Rodríguez J, Aguilera-López P, Cassinello-García E. Recurrence risk after a withdrawal of antiepileptic drugs in children with epilepsy: a prospective Eur J Paediatr Neurol. 2010; 14: 116-24. doi: 10.1016/j.ejpn. 2009.05.006.
- Berg AT, Vickrey BG, Langfitt JT, Sperling MR, Shinnar S, Bazil C, et al; Multicenter study of Epilepsy Surgery. Reduction of AEDs in postsurgical patients who attain remission. 2006; 47: 64-71. doi: 10.1111/j.1528-1167 .2006.00371.x.
- Kerling F, Pauli E, Lorber B, Blümcke I, Buchfelder M, Stefan H. Drug withdrawal after successful epilepsy surgery: How safe is it? Epilepsy Behav. 2009; 15: 476-80. doi: 1016/j.yebeh.2009.05.016.
- Ladino LD, Hernández-Ronquillo L, Téllez-Zenteno JF. Management of antiepileptic drugs following epilepsy surgery: a meta-analysis. Epilepsy 2014; 108: 765-74. doi. 10.1016/j.eplepsyres.2014.01.024.
- Harroud A, Weil AG, Bouthillier A, Nguyen DK. Prognostic tests and antiepileptic drug withdrawal after epilepsy Can J Neurol Sci. 2014; 41: 409-12 doi: 10.1017/ S0317167100018412.

