ESTILO DE VIDA EN PACIENTE EPILÉPTICO
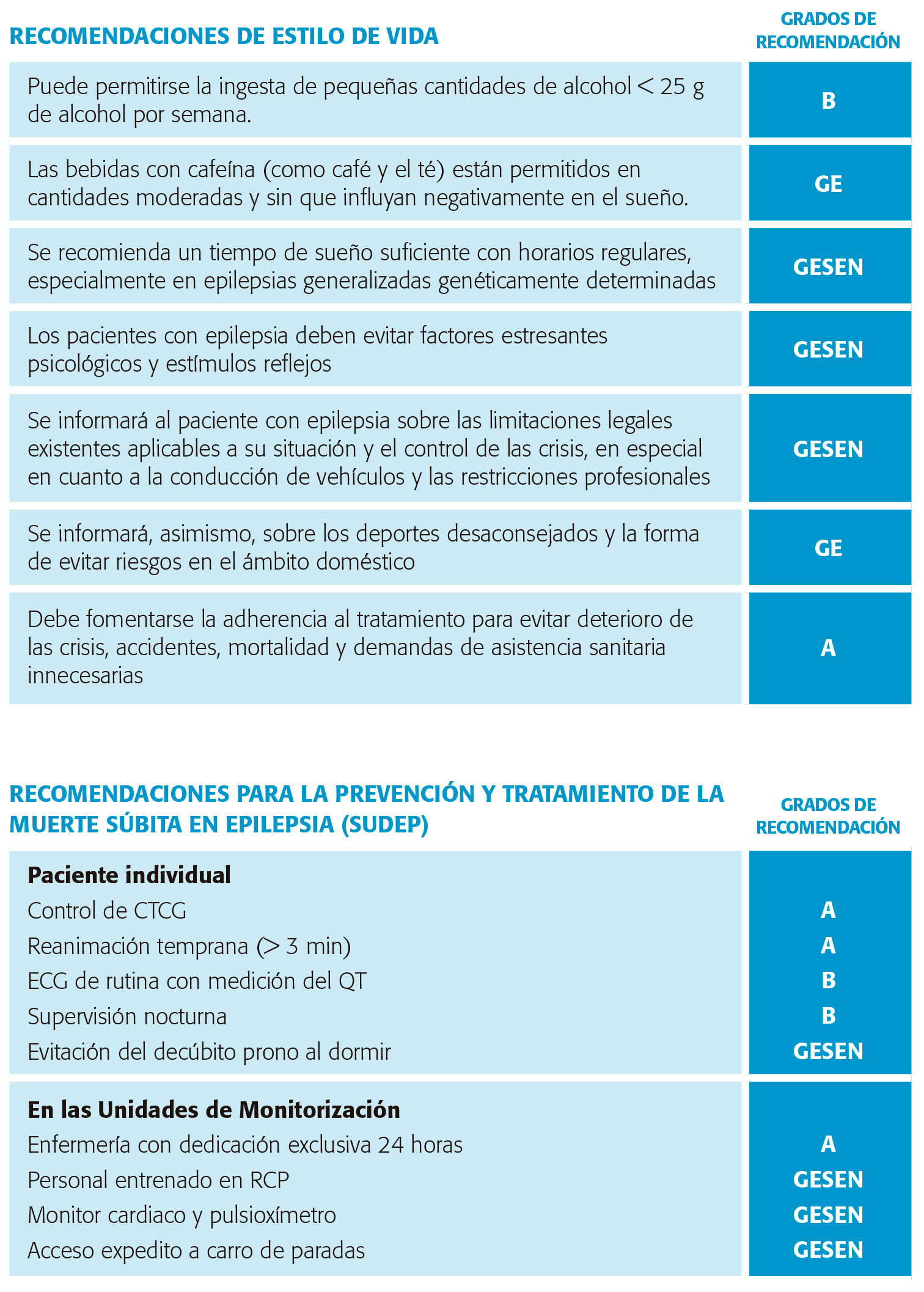
La mayoría de las personas con epilepsia (PCE) llevan una vida sin grandes limitaciones, sujetas a la legislación vigente al respecto. Determinados hábitos de vida saludable contribuyen a un mejor control de las crisis. Un abordaje terapéutico integral contemplará recomendaciones para evitar factores desencadenantes de CE (tabla V) además del uso de FAE.

Riesgos domésticos
En la vivienda, los mayores riesgos surgen en la cocina, el baño o las escaleras. Algunas medidas sencillas disminuyen estos riesgos: muebles sin aristas, camas bajas, sistemas de seguridad para el agua caliente, protección de placas de cocina, cocina de inducción, evitar puertas de cristal en casa y en los baños y colocar puertas que abran hacia fuera para no bloquear la salida en caso de que el paciente se quede apoyado sobre ella. En el caso del cuidado de bebés, se aconseja, a la hora de tomarlos en brazos, colocarse en el suelo rodeado de cojines o un entorno blando.
Actividades deportivas
Como en cualquier otra persona, la práctica de ejercicio físico tiene efectos positivos en las PCE, incluyendo una mejora de la autoestima, sociabilidad y mejora de la salud general a largo plazo, e incluso puede ayudar a un mejor control de las CE en algunas personas. Con frecuencia se ha desaconsejado la práctica de estas actividades, por miedo, sobreprotección o ignorancia. Para la mayoría de estas actividades no existen regulaciones específicas en este sentido. La ILAE21 reconoce estas carencias legales y aboga por individualizar la situación en cada persona según su estado de control de crisis y sus necesidades vitales e interés que muestre el paciente en determinadas prácticas deportivas, con mayores limitaciones en actividades deportivas que pueden poner en peligro la vida de otras personas (tabla VI). Respecto a las profesiones desaconsejables y la conducción de vehículos, remitimos al lector al capítulo correspondiente.
ADHERENCIA TERAPÉUTICA (AT)22
La evidencia existente muestra que la adherencia al tratamiento en PCE oscila entre el 50-70 % similar a otras patologías crónicas. Los factores que influyen en este patrón son múltiples y muy complejos. Una mala AT es responsable de un aumento del número y gravedad de las crisis llegando a duplicar los ingresos hospitalarios y los accidentes de tráfico y triplicando el riesgo de muerte, incluyendo SUDEP. Puede ser causa de pseudorrefractariedad de las crisis, sobre todo en jóvenes. Claras explicaciones de cómo usar los FAE, así como el uso de regímenes sencillos de medicación en monoterapia y con el menor número posible de dosis tienen un efecto positivo sobre la AT. Nivel de evidencia II.
EPILEPSIAS REFLEJAS
Estímulos precipitantes de crisis23,24
Los precipitantes externos de crisis, al ser referidos por los mismos pacientes, pueden ser muy subjetivos. Situaciones comunes pueden asociarse con el inicio de las crisis, lo que aumenta la posibilidad de falsos positivos. El estímulo precipitante de crisis más mencionado por las PCE es el estrés emocional. La privación del sueño y el cansancio también se mencionan con frecuencia, independientemente del tipo de epilepsia (tabla V).
Crisis reflejas25-27
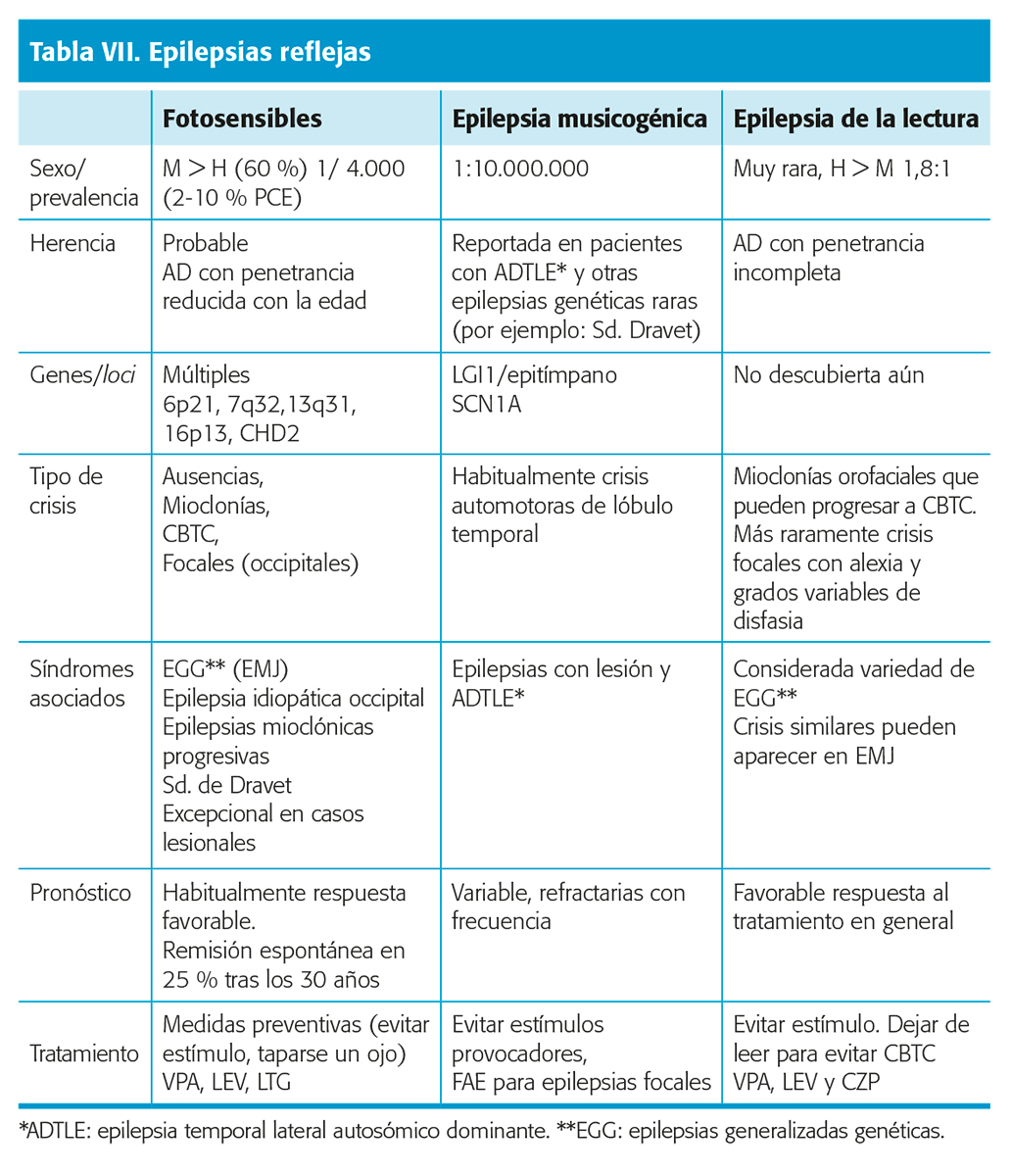
Las crisis epilépticas reflejas son aquellas que ocurren segundos o minutos después de un estímulo precipitante bien definido. Epilepsias reflejas son aquellas en las que las crisis epilépticas son desencadenadas, a veces de forma exclusiva por un estímulo epiléptico reflejo sensorial o cognitivo. Los estímulos precipitantes son cualitativamente, y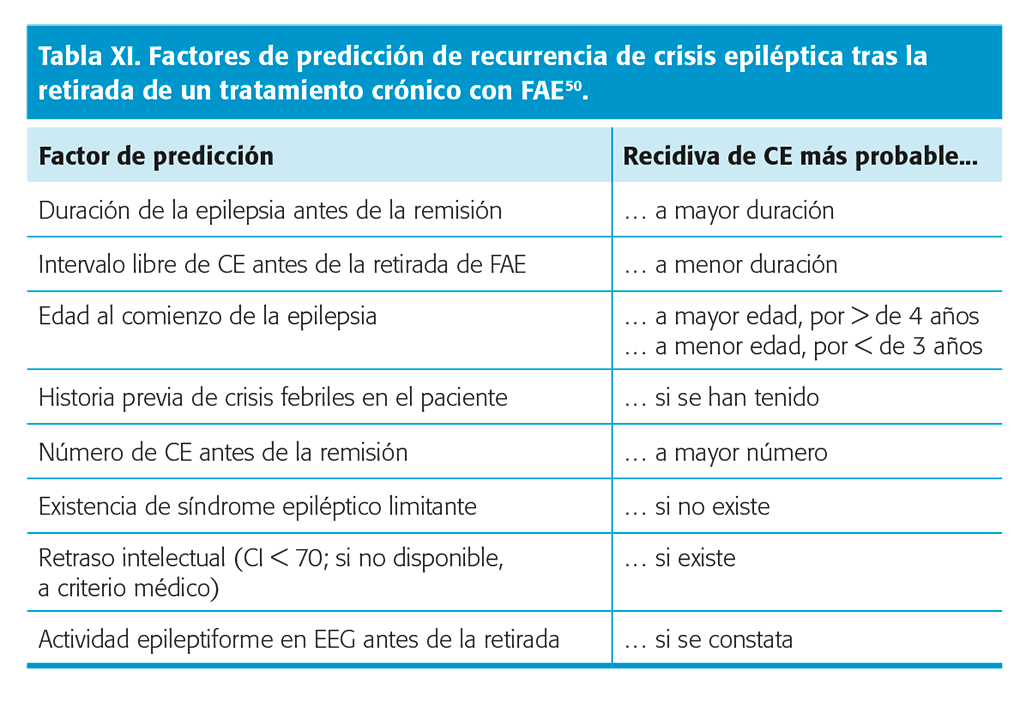 con frecuencia cuantitativamente, bien definidos y específicos para el tipo de crisis. Las crisis reflejas ofrecen posibilidades únicas para estudiar mecanismos de generación de crisis en epilepsias humanas. Además, su valor clínico es ahora más relevante ante la nueva definición de epilepsia de la ILAE que permite realizar el diagnóstico de epilepsia ante una única crisis de este tipo. La fotosensibilidad, expresada como respuestas fotoparoxísticas en el EEG y crisis generalizadas o focales ante la presentación de determinados estímulos visuales constituye el rasgo reflejo más frecuente en las epilepsias humanas, sin categoría de síndrome específico por parte de la ILAE (tabla VII).
con frecuencia cuantitativamente, bien definidos y específicos para el tipo de crisis. Las crisis reflejas ofrecen posibilidades únicas para estudiar mecanismos de generación de crisis en epilepsias humanas. Además, su valor clínico es ahora más relevante ante la nueva definición de epilepsia de la ILAE que permite realizar el diagnóstico de epilepsia ante una única crisis de este tipo. La fotosensibilidad, expresada como respuestas fotoparoxísticas en el EEG y crisis generalizadas o focales ante la presentación de determinados estímulos visuales constituye el rasgo reflejo más frecuente en las epilepsias humanas, sin categoría de síndrome específico por parte de la ILAE (tabla VII).
MUERTE SÚBITA
La muerte súbita en epilepsia (MSE) es la principal causa de muerte relacionada con la epilepsia y afecta aproximadamente a 1/1.000 pacientes/año28. Después del ictus, la MSE constituye la segunda causa de años potenciales de vida perdidos29 dentro de las enfermedades neurológicas.
Definición
Muerte súbita, inesperada, presenciada o no, que ocurre en circunstancias benignas en un individuo con epilepsia, con o sin evidencia de una crisis en el que el examen post mortem no revela una causa de muerte. La muerte no ocurre por traumatismo o ahogamiento y se excluye el estado de mal epiléptico documentado.
Clasificación
Existen diferentes categorías de precisión diagnóstica: posible, probable, definitiva, cuasi-MSE y una subcategoría “plus” cuando existe otra causa posible de muerte, pero no se ha establecido su implicación30 (tabla VIII).
Epidemiología en España
En un estudio poblacional de mortalidad relacionada con la epilepsia en Málaga, la incidencia de MSE fue de 0,56 por 1.000 pacientes/año31. Sin embargo, en el primer reporte español realizado por una Unidad de Monitorización de Epilepsia, la incidencia de MSE fue de 1,3/1.000 pacientes por año, casi tres veces mayor que la descrita en el estudio poblacional32. Basados en los resultados del proyecto EPIBERIA, para una prevalencia de epilepsia activa de 5,79 por cada 1.000 habitantes, fallecerían alrededor de 150 pacientes/año debido a MSE, pero esta cifra ascendería a 350 pacientes/año en el grupo de las epilepsias farmacorresistentes. Nivel de evidencia II.
Factores de riesgo
Estudios epidemiológicos han demostrado la existencia de factores de riesgo específicos para MSE, algunos de los cuales podrían prevenirse.
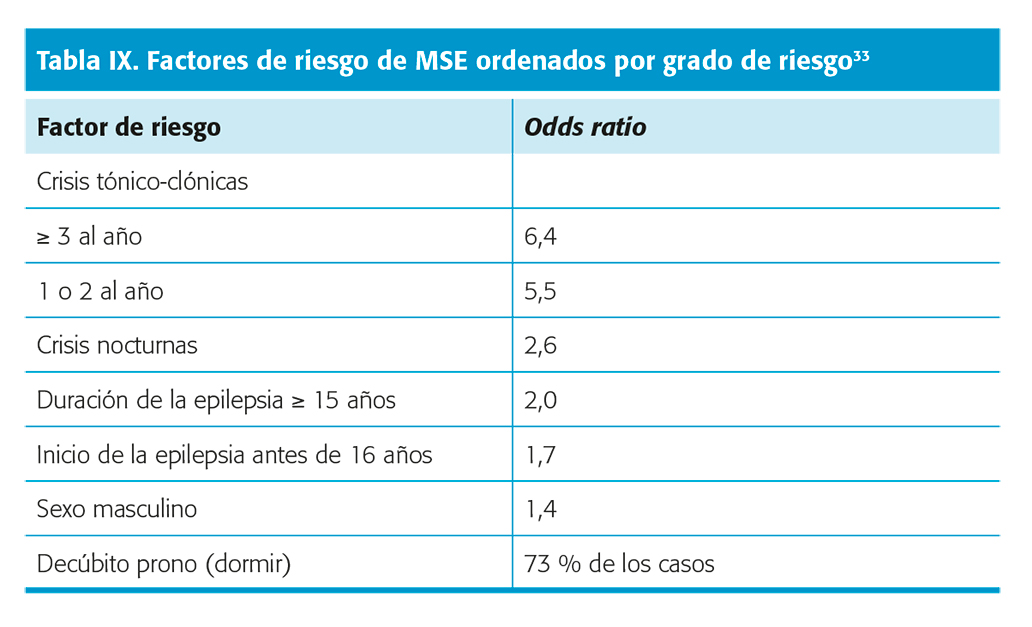
El mayor factor de riesgo es la presencia de crisis tónico-clónicas no controladas. Los factores de riesgo detectados por metanálisis incluyen crisis tónico-clónicas frecuentes, crisis nocturnas, duración de la epilepsia de 15 años o más, inicio de la epilepsia antes de los 16 años, sexo masculino y posición en decúbito prono33(tabla IX).
En el estudio español, todos los pacientes tenían epilepsia focal y sufrían convulsiones tónico-clónicas generalizadas. Todos los casos presenciados ocurrieron después de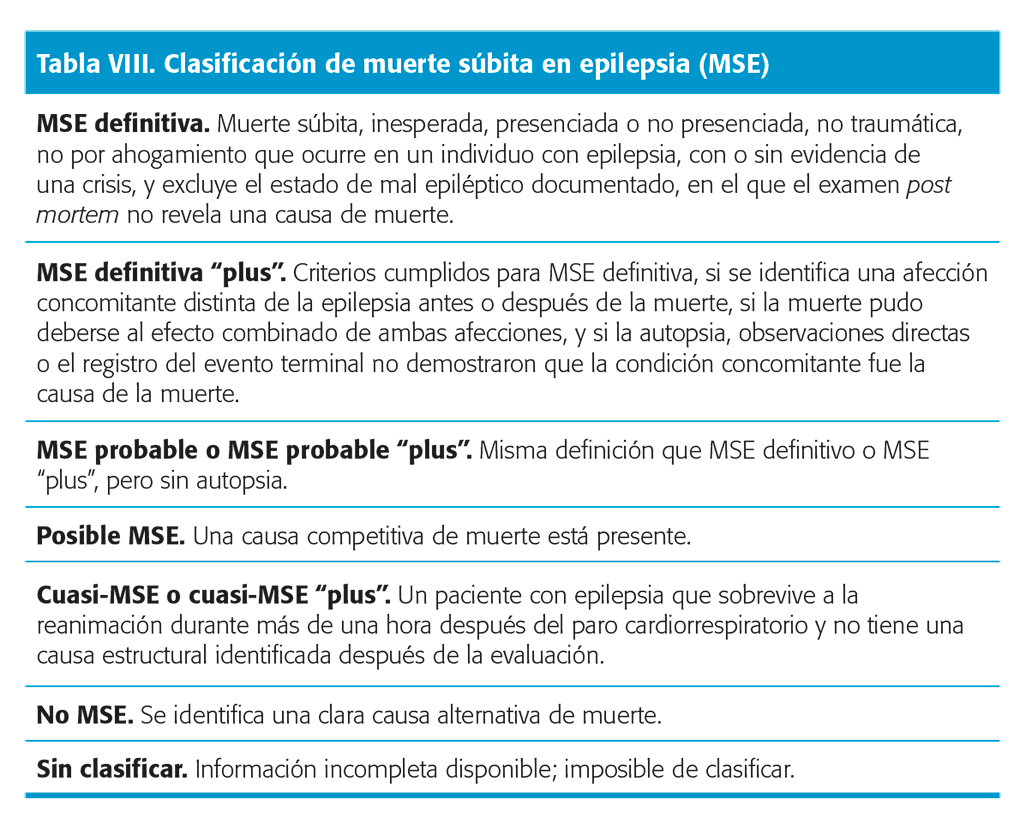
una crisis tónico-clónica focal con evolución a bilateral. Cuatro casos se produjeron durante el sueño y todos los casos no presenciados se encontraron en posición prono. Un caso ocurrió durante la monitorización de video-EEG32. Nivel de evidencia II.
Causas
Los mecanismos etiopatogénicos de la MSE no están completamente dilucidados. El proyecto MORTEMUS analizó casos de MSE ocurridos en Unidades de Monitorización Epilepsia (UME). Se concluyó que el mecanismo principal que conduce a MSE comienza con una alteración grave de las funciones respiratorias y cardiacas después de CGTC, en forma de un fallo neurovegetativo postictal temprano3434. Nivel de evidencia II.
Biomarcadores
Se distinguen 3 tipos de biomarcadores para MSE: genéticos, electrofisiológicos y de neuroimagen (tabla X).
Ciertos genes tienen influencia tanto en el cerebro como en el corazón y son responsables del desarrollo de epilepsia y arritmias cardiacas. Aquellos que ocasionan síndrome de QT largo no sólo pueden generar arritmias potencialmente fatales, sino también epilepsia35. Otro caso es la mutación del gen SCN1A, responsable del síndrome de Dravet y que se asocia con un riesgo elevado de MSE36. Sin embargo, los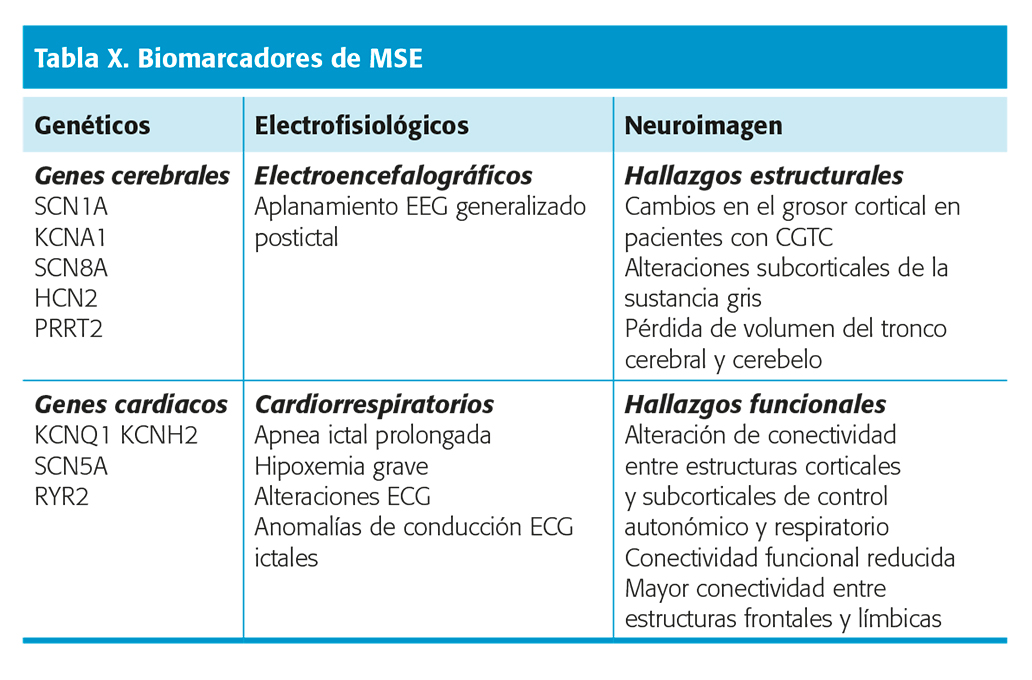 factores genéticos de la MSE son complejos y se relacionarían en una combinación de polimorfismos de nucleótidos y variaciones del número de copias en diferentes genes involucrados en circuitos de control cardiorespiratorio33.
factores genéticos de la MSE son complejos y se relacionarían en una combinación de polimorfismos de nucleótidos y variaciones del número de copias en diferentes genes involucrados en circuitos de control cardiorespiratorio33.
Los marcadores electrofisiológicos comprenden:
- Supresión generalizada del EEG postictal (PGES), definido como la reducción de la amplitud EEG menor de 10 μ V, que ocurre eventualmente tras CGTC37. Sin embargo, este marcador ha sido criticado últimamente como inespecífico por lo que debe ser tomado con precaución38.
- Apnea o hipoxemia postictal39. La apnea ictal prolongada (≥ 60 s) se asocia con hipoxemia grave y puede ser un posible biomarcador SUDEP40.
- Alteraciones ECG interictales o ictales pueden ser biomarcadores de MSE41.
Los biomarcadores obtenidos por neuroimagen incluyen análisis morfométricos y de conectividad funcional (RNMf). En general, las alteraciones volumétricas indican daño estructural de vías de control clave para la función autonómica y respiratoria.
Los estudios funcionales muestran una alteración de la conectividad entre estructuras corticales y subcorticales relacionadas con el control autonómico y respiratorio además de una conectividad funcional reducida o bien una mayor conectividad entre estructuras frontales y límbicas en pacientes de alto riesgo42. Sin embargo, estos estudios se basan en pacientes de alto riesgo y no exclusivamente en aquellos que han sufrido MSE; por lo tanto, sus resultados deben ser tomados con precaución. Nivel de evidencia II.
Prevención y tratamiento
Los resultados de los estudios multicéntricos, así como de las series de caso publicados en la literatura, sugieren las normas de prevención de la MSE tanto en el paciente individual como en Unidades de Monitorización de Epilepsia reflejadas en la página siguiente. Nivel de evidencia II.
Bibliografía
- Capovilla G, Kaufman KR, Perucca E, Moshé SL, Arida RM. Epilepsy, seizures, physical exercise, and sports: A report from the ILAE Task Force on Sports and Epilepsy. Epi 2016; 57(1): 6-12.
- Parra J. Adherencia terapéutica en epilepsia. Majadahonda: Comunicación y Ediciones Sanitarias, L; 2016. Pp 1-61.
- Bartolini E, Sander Dealing with the storm: an overview of seizure precipitants and spontaneous seizure worsening in drug-resistant epilepsy. Epilepsy Behav. 2019; 97: 212-8.
- Ferlisi M, Shorvon S. Seizure precipitants (triggerin factors) in patients with epilepsy. Epilepsy 2014; 33: 101-5.
- Okudan ZV, Özkara Ç. Reflex epilepsy: triggers and management strategies. Neuropsychiatr Dis 2018; 14: 327-37.
- Parra J, Kalitzin SN, Lopes da Silva FH. Photosensitivity and visually induced seizures. Curr Opin 2005; 18(2): 155-9.
- Szúcs A, Rosdy B, Kelemen A, Horváth A, Halász P. Reflex seizure triggering: learning about seizure producing Seizure. 2019; 69: 25-30.
- Harden C, Tomson T, Gloss D, Buchhalter J, Cross JH, Donner E, et al. Practice guideline summary: sudden unexpected death in epilepsy incidence rates and risk factors: Report of the Guideline Development, Dissemination, and Implementation Subcommittee of the American Academy of Neurology and the American Epilepsy Neurology. 2017; 88: 1674-80.
- Thurman DJ, Hesdorffer DC, French JA. Sudden unexpected death in epilepsy: assessing the public health Epilepsia. 2014; 55: 1479-85.
- Nashef L, So EL, Ryvlin P, Tomson T. Unifying the definitions of sudden unexpected death in Epilepsia. 2012; 53: 227-33.
- Chamorro-Muñoz MI, López-Hidalgo E, García-Martín G, Rodríguez-Belli AO, Gutiérrez-Bedmar M. Sudden unexpected death in epilepsy: incidence at a Spanish epilepsy unit. Neurologia. 2017 Dec 14. pii: S0213-4853(17)30348-1. doi: 10.1016/j. 2017.10.003. [Epub ahead of print].
- Sanchez-Larsen A, Fernandez-Perez I, Principe A, Ley M, Rocamora R. SUDEP in Spain: first case series and epidemiological Seizure. 2019; 69(May): 258-64.
- Hampel KG, Rocamora R, Quesada CM. Desentrañando los misterios de la muerte súbita en Neurología. 2017; 17: 30142-1.
- Ryvlin P, Nashef L, Lhatoo SD, Bateman LM, Bird J, Bleasel A, et Incidence and mechanisms of cardiorespiratory arrests in epilepsy monitoring units (MORTEMUS): a retrospective study. Lancet Neurol. 2013; 12: 966-77.
- Johnson JN, Hofman N, Haglund CM, Cascino GD, Wilde AA, Ackerman MJ. Identification of a possible pathogenic link between congenital long QT syndrome and Neurology. 2009; 72: 224-31.
- Sakauchi M, Oguni H, Kato I, Osawa M, Hirose S, Kaneko S, et al. Retrospective multiinstitutional study of the prevalence of early death in Dravet syndrome. Epilepsia. 2011; 52: 1144-9.
- Lhatoo SD, Faulkner HJ, Dembny K, Trippick K, Johnson C, Bird JM. An electroclinical case-control study of sudden unexpected death in Ann Neurol. 2010; 68: 787-96.
- Lamberts RJ, Gaitatzis A, Sander JW, Elger CE, Surges R, Thijs RD. Postictal generalized EEG suppression: an inconsistent finding in people with multiple seizures. Neurology. 2013; 81: 1252-6.
- Bateman LM, Li CS, Seyal M. Ictal hypoxemia in localization- related epilepsy: analysis of incidence, severity and risk Brain J Neurol. 2008; 131(Pt 12): 3239-45.
- Lacuey, N., Zonjy, B., Hampson, et al. The incidence and significance of periictal apnea in epileptic Epilepsia 2018; 59(3), 573-582. https://doi.org/10.1111/ epi.14006.
- Lacuey N, Zonjy B, Hampson JP, Rani MRS, Zaremba A, Sainju RK, et al. Who to target in sudden unexpected death in epilepsy prevention and how? Risk factors, biomarkers, and intervention study Epilepsia. 2016; 57: 4-16.
- Allen LA, Harper RM, Lhatoo S, Lemieux L, Diehl Neuroimaging of sudden unexpected death in epilepsy (SUDEP): Insights from structural and resting-state functional MRI studies. Frontiers in Neurology. 2019; 10: 1-8.

