INTRODUCCIÓN
Los estudios epidemiológicos de base poblacional demuestran que los pacientes con epilepsia (PCE) presentan una mayor prevalencia de patologías comórbidas, tanto somáticas como psiquiátricas y neurológicas. Así, aproximadamente un 50 % de los adultos con epilepsia activa tiene al menos un trastorno médico comórbido. Progresivamente se va teniendo mayor consciencia del impacto que dichas comorbilidades tienen en la calidad de vida del PCE en incluso en el grado de control de la epilepsia78.
Los mecanismos que explican estas asociaciones son diversos. Así, siguiendo el esquema propuesto por Keezer et al.79, podemos distinguir 5 categorías de asociación:
- Asociación artefactual: no hay una mayor prevalencia de la patología comórbida en PCE respecto de la población general. No hay, por tanto, una asociación causal, pero sí son situaciones que se merecen abordar por las implicaciones clínicas y terapéuticas que pueden tener.
- Asociaciones causales: la patología comórbida surge en primer lugar y genera el síndrome epiléptico. Ejemplos: ictus, que es responsable del 10 % de los casos incidentes de epilepsia como causa directa y el tabaquismo, como causa directa y el tabaquismo, como causa indirecta.
- Mecanismos resultantes: similar al anterior, pero con secuencia temporal invertida. La epilepsia precede a la patología comórbida, que es secundaria a Por ejemplo: neumonía aspirativa o fracturas esqueléticas secundarias a crisis.
- Factores de riesgo compartidos: epilepsia y patología comórbida surgen por los mismos factores de riesgo. Estos factores de riesgo pueden ser de índole genética, ambiental o estructural. Un ejemplo podría ser la comorbilidad entre epilepsia y paraparesia espástica en relación a encefalopatía hipóxica perinatal.
- Efectos bidireccionales: en este caso, la epilepsia provoca la comorbilidad y la comorbilidad provoca epilepsia. Algunos investigadores argumentan que este puede ser el caso de la epilepsia que aparece en el seno de los trastornos del espectro autista.
Todas estas constituyen situaciones especiales con implicaciones diagnósticas y terapéuticas que analizaremos de forma individualizada.
EPILEPSIA Y ENFERMEDAD CEREBROVASCULAR
Es conocido que existe una estrecha relación bidireccional entre ictus y epilepsia. Así, los ictus son responsables del 45 % de los casos incidentes de epilepsia en pacientes mayores de 60 años y, por otro lado, la prevalencia relativa de ictus en pacientes con epilepsia oscila entre el 4 y el 15 %80, siendo, por tanto, considerablemente superior a la de la población general. Las razones que explican esta asociación, pueden ser múltiples y a veces no tan evidentes y obligan a considerar esta asociación como una situación especial frecuente en la práctica clínica.
Recomendaciones terapéuticas
- Profilaxis primaria: sólo hay un ensayo clínico controlado (ECC) que evalúa la profilaxis primaria de la epilepsia en el ictus isquémico en fase aguda. Este ECC evaluó el uso de VPA frente a placebo y demostró que no existía beneficio81. Nivel de evidencia I. Tampoco existen evidencias que apoyen la profilaxis primaria de las crisis en pacientes con trombosis venosas cerebrales y/o hemorragia subaracnoidea.
- Manejo de crisis en fase aguda: se han de contemplar dos situaciones diferentes:
- Crisis en las primeras 24 horas tras el ictus: se debe asumir que son crisis sintomáticas agudas (CSA) y es necesario identificar los posibles factores precipitantes (metabólicos, infecciosos, edema cerebral) antes de decidir las opciones terapéuticas. En muchas ocasiones el simple control de los factores predisponentes es
- Crisis tempranas recurrentes post ictus o status epiléptico: las que ocurren en el transcurso de la primera semana después del En este caso, la mayoría de las veces las crisis pueden ser fácilmente controladas usando un solo FAC.
Los FAC de elección serán aquellos que dispongan de posibilidad de administración IV: BZD, PHT, LEV, VPA, LCM o BRV. No existen estudios que nos muestren preferencia por alguno, por lo que se habrán de utilizar las recomendaciones generales de uso de FAC en función de tipo de crisis y comorbilidades, que recogemos en la tabla XXVI.
- Epilepsia post ictus: es un verdadero síndrome epiléptico cuya etiología es la lesión parenquimatosa secuelar al Para la elección del FAC en la epilepsia postictus deben seguir las mismas recomendaciones que para el tratamiento crónico de la epilepsia sintomática en general, a cuyo capítulo nos remitimos.
En general la epilepsia postictus tener buena respuesta a FAC por lo que, generalmente, será suficiente utilizar un FAC apropiado para crisis focales en régimen de monoterapia82.

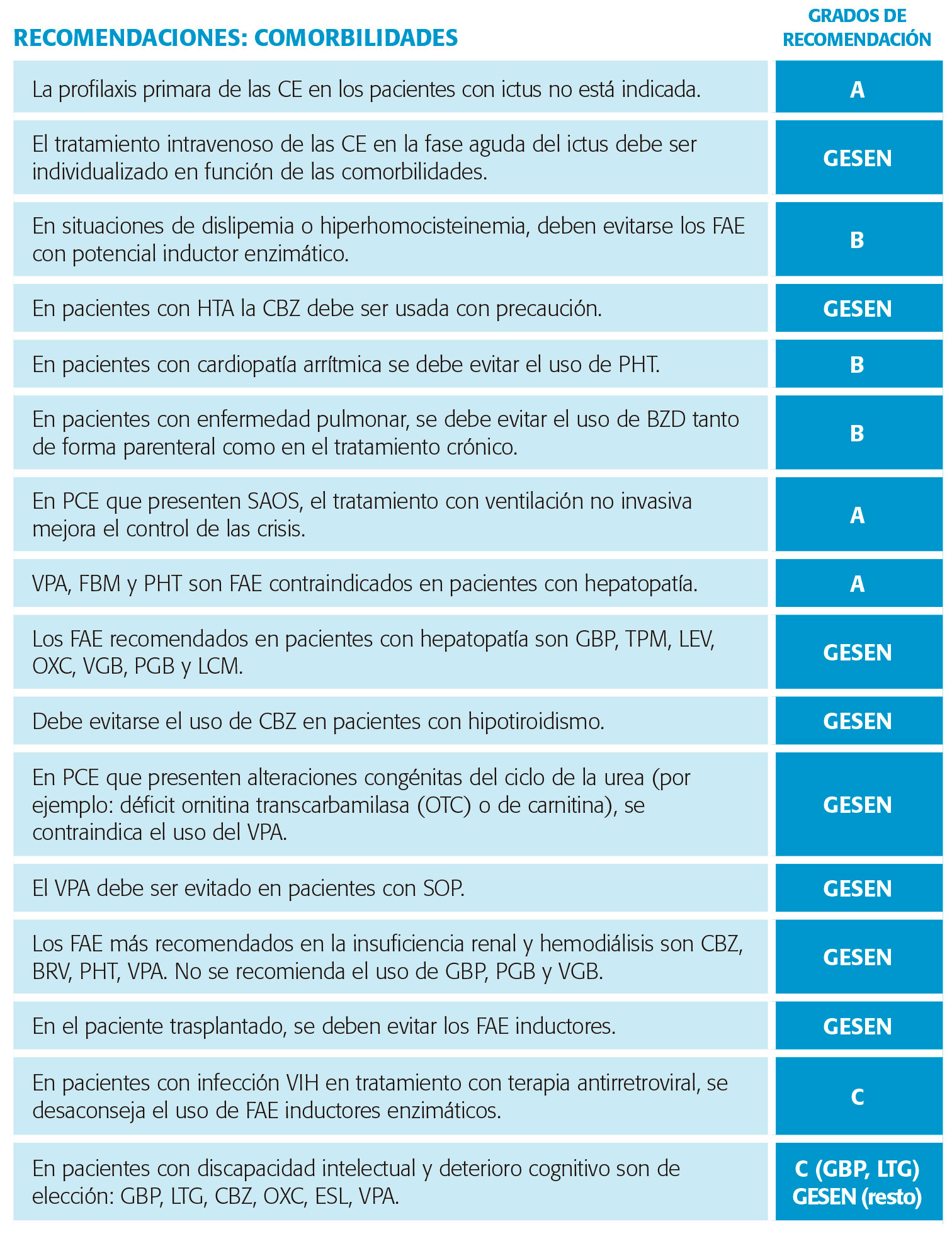
Es importante tener en cuenta que un paciente con antecedentes de ictus puede tener comorbilidades somáticas ligadas con el aumento del riesgo vascular, como la HTA, la ateromatosis o la dislipemia. Desde este punto de vista, la tabla XXVII refleja algunas de las consideraciones importantes a tener en cuenta.
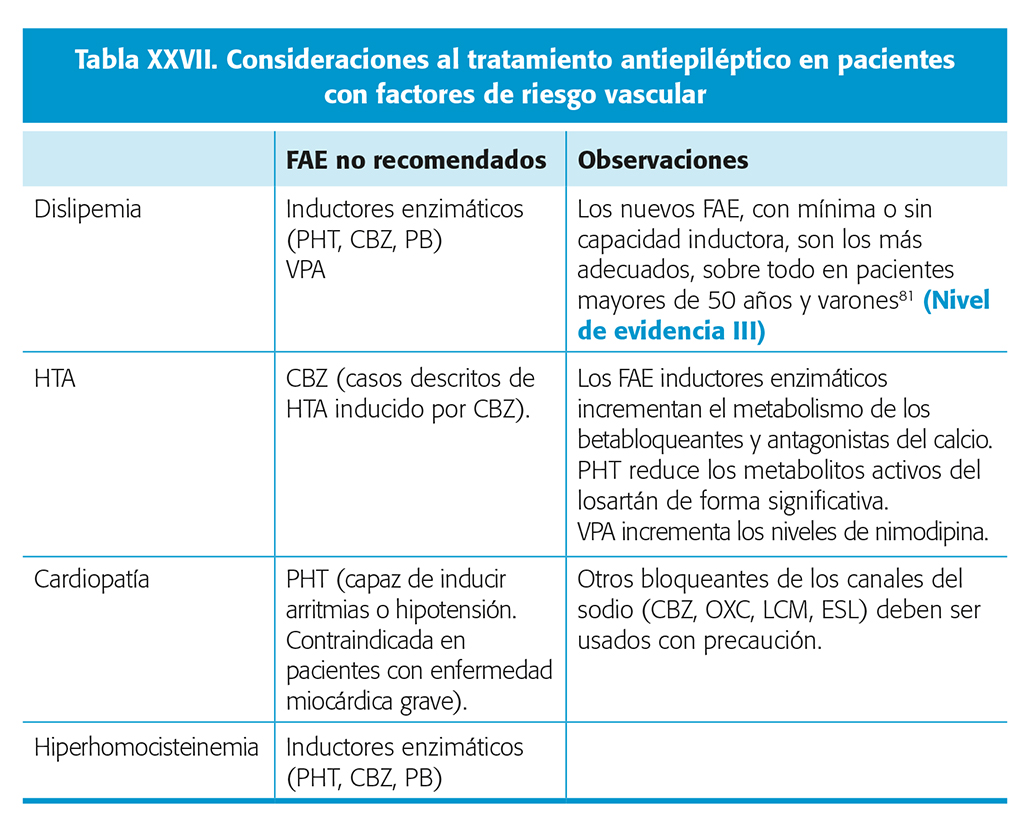
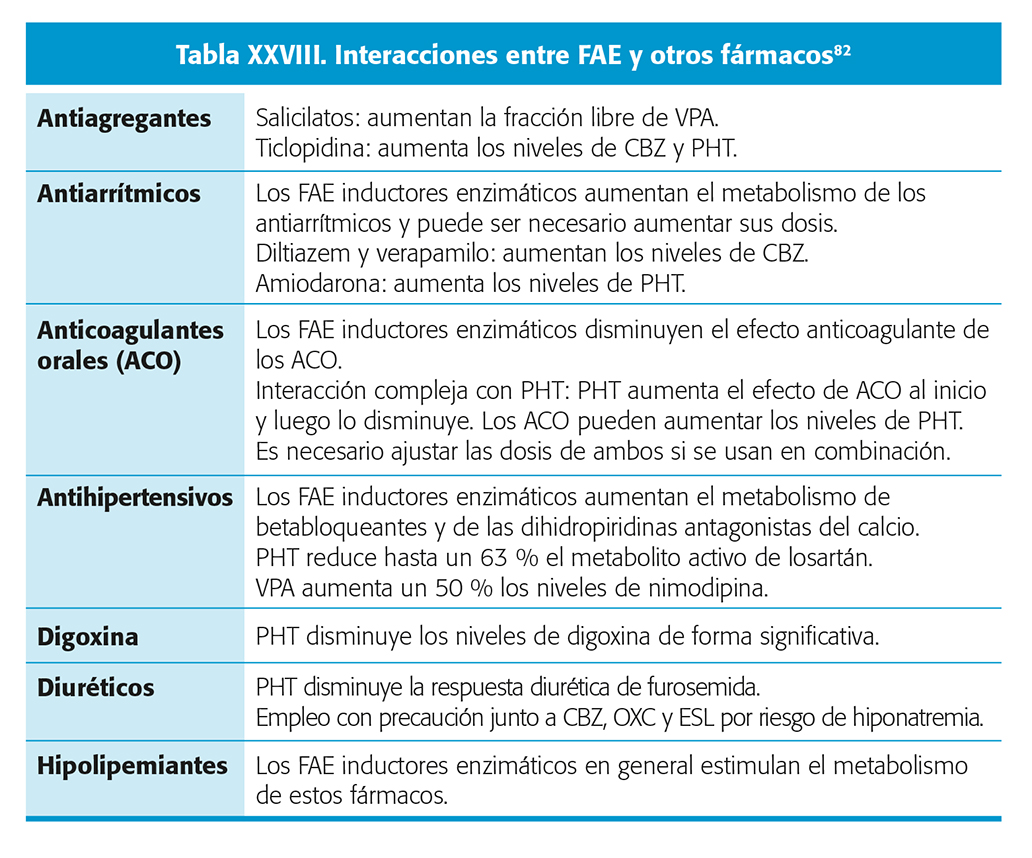
Por último, los pacientes con enfermedad cardio y cerebrovascular suelen estar sometidos a tratamientos múltiples por otras patologías. Por este motivo, es importante tener en mente la posibilidad de interacciones con los fármacos usados para dichas comorbilidades. En la tabla XXVIII se resumen algunas de las principales consideraciones a tener en cuenta en este sentido.
EPILEPSIA Y ENFERMEDAD RESPIRATORIA
El principal reto terapéutico cuando coexisten enfermedades que producen insuficiencia respiratoria y epilepsia concierne al uso de las BZD, que son FAC con conocido poder depresor de la función respiratoria y, por tanto, deben ser considerados contraindicados en estas situaciones en fase aguda. Esta afirmación está corroborada, al menos, por un estudio controlado sobre pacientes con estado epiléptico en el que se constató una mayor incidencia de depresión respiratoria en el grupo tratado con BZD85. Nivel de evidencia II. Además, las BZD usadas de forma crónica se ha relacionado con el aumento de las secreciones respiratorias en pacientes niños con epilepsia.
También la PHT, usada por vía parenteral, se ha relacionado con insuficiencia respiratoria, por lo que también debe ser utilizada con precaución en pacientes con enfermedades respiratorias.
De especial interés es la comorbilidad entre epilepsia y síndrome de apnea obstructiva del sueño (SAOS). Un pequeño ECC publicado en 2008 mostró que el tratamiento adecuado del SAOS con CPAP se correlacionaba con mejor control de las crisis en PCE. Nivel de evidencia I86. Más recientemente, un estudio retrospectivo ha demostrado que la coexistencia de epilepsia y SAOS aumenta el riesgo de muerte súbita, lo que también supone un incentivo para investigarlo y tratarlo siempre.
EPILEPSIA Y ENFERMEDADES DEL TRACTO DIGESTIVO
Existen algunas consideraciones a tener en cuenta en el tratamiento del PCE cuando coexistan comorbilidades con enfermedades el tracto digestivo, fundamentalmente referidas a las posibles interacciones de los FAC con los fármacos requeridos para dichas patologías. En la tabla XXIX se revisan estas interacciones.

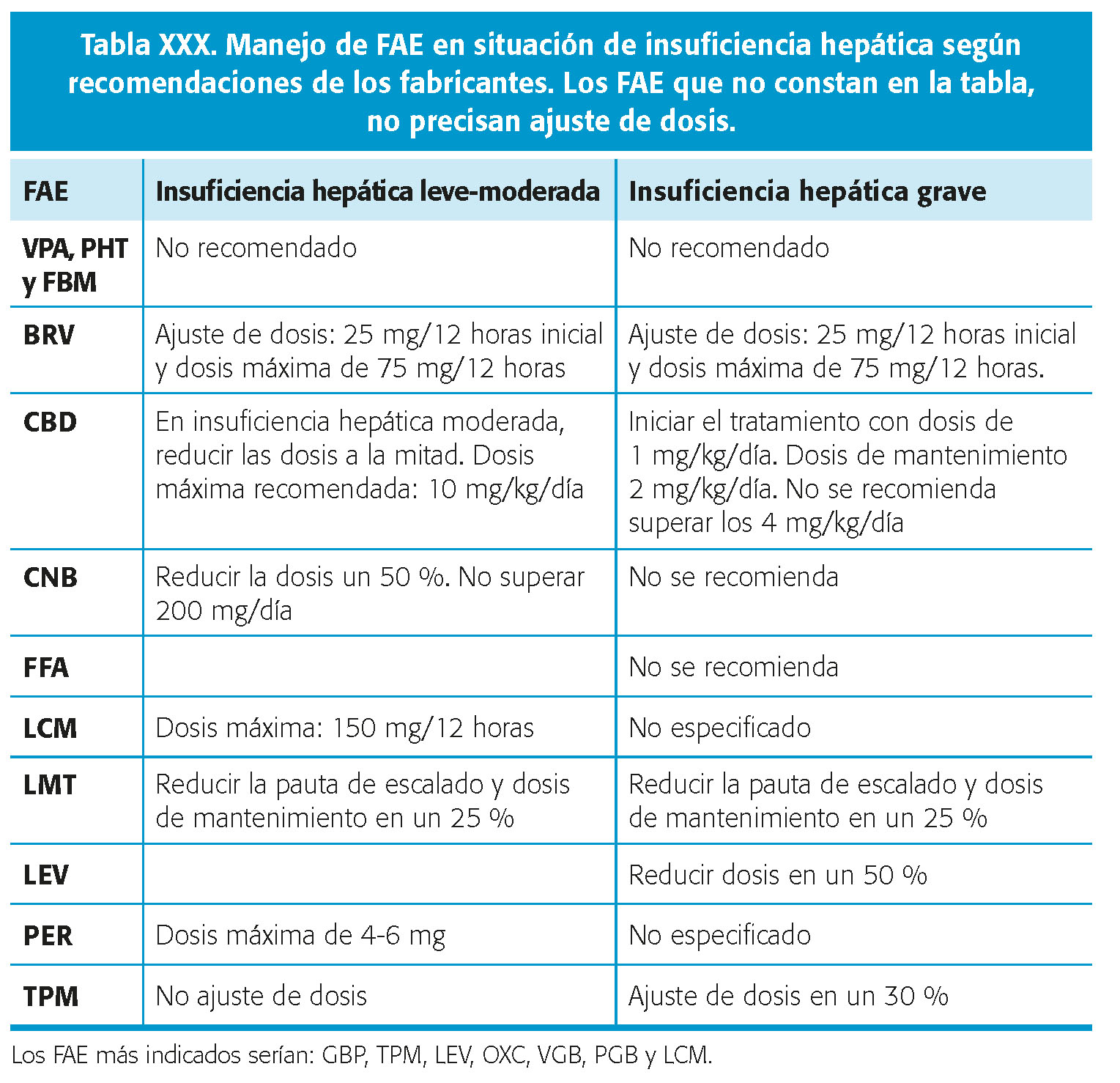
Un capítulo aparte supone el manejo de pacientes en situación de hepatopatía con fallo funcional. Es importante, en estos casos, tener claros algunos conceptos básicos de manejo de FAC, que resumimos en la tabla XXX.
EPILEPSIA Y ENFERMEDADES METABÓLICAS Y ENDOCRINOLÓGICAS
Los PCE pueden sufrir comorbilidades metabólicas o endocrinológicas que hay que saber manejar, pero tal vez tenga más importancia el conocimiento de los efectos que los FAC pueden ejercer sobre los diferentes sistemas metabólicos.
- Metabolismo óseo y de la vitamina D: los FAC inductores enzimáticos (PHT, CBZ, PB) pueden afectar al metabolismo óseo a través de un incremento del catabolismo de las formas activas de vitamina D hacia formas inactivas llevando a una situación crónica de hiperparatiroidismo secundario. Existen evidencias directas de que los tratamientos crónicos con FAC inductores provocan una caída de
 densidad mineral ósea más evidente en mujeres ancianas, así como un aumento del riesgo de fractura y de que también el VPA puede conducir a situaciones de osteopenia-osteoporosis87. Probablemente, los EA del VPA deban ser explicados por una vía completamente diferente que la implicada en los FAC inductores.
densidad mineral ósea más evidente en mujeres ancianas, así como un aumento del riesgo de fractura y de que también el VPA puede conducir a situaciones de osteopenia-osteoporosis87. Probablemente, los EA del VPA deban ser explicados por una vía completamente diferente que la implicada en los FAC inductores. - Metabolismo de esteroides sexuales: estudios tanto en hombres como en mujeres han demostrado un descenso significativo de los niveles plasmáticos de la forma activa de testosterona en pacientes en tratamiento con FAC inductores (sobre todo CBZ y PTH), lo que se ha correlacionado con disfunción sexual relevante en PCE88.
- Metabolismo de esteroides adrenales: el metabolismo adrenal puede ser alterado por los inductores potentes del CYP, que pueden hacer disminuir la vida media de los esteroides usados en las terapias de reposición hormonal e incrementar el requerimiento de corticoides en pacientes con hipoadrenalismo o con hiperplasia adrenal congénita.
- Eje hormonal tiroideo: los FAC con capacidad inductora sobre el sistema UGT pueden alterar la ruta metabólica del tiroides a través de varios mecanismos, incluyendo la unión competitiva a las globulinas transportadoras de la tiroxina, incrementando la conversión periférica de T4 a T3 activa e interfiriendo con eje hipotálamo-hipofisario89.
Las consecuencias de estas alteraciones es la inducción de un hipotiroidismo que puede ser clínico o subclínico a expensas de una disminución de los niveles de T4 libre y una elevación de los niveles de TSH. De los FAC disponibles, la CBZ parece ser el que produce este efecto con más frecuencia, llegando hasta un 30 % de los pacientes.
Los estudios disponibles con FAC no inductores o FAC inhibidores de la UGT (vg VPA) no provocan alteraciones significativas del metabolismo tiroideo.
- Alteraciones del ciclo de la urea: el propionato, un metabolito del VPA es capaz de inducir una caída de los niveles hepáticos de N-acetilglutamato (NAG), enzima responsable de la activación de la carbamil-fosfato-sintetasa I (CPS-I), que inicia el ciclo de la Otro metabolito del VPA, el 4-en-VPA, causa un descenso en la disponibilidad de acetil-CoA, necesario para producir NAG, por lo que los niveles de NAG también caen durante el tratamiento con VPA por este motivo.
La consecuencia de la disminución de NAG es una elevación de los niveles de amonio sérico. En sujetos sanos, esta elevación es moderada y no tiene repercusión clínica. Sin embargo, si el paciente padece simultáneamente alguna deficiencia enzimática del ciclo de la urea, la situación es diferente. Los déficits más habituales son el de ornitina transcarbamilasa (OTC) o el de carnitina (congénita o adquirida en el contexto de un fallo hepático o una dieta vegetariana).
Así, ante el desarrollo de una encefalopatía hiperamoniémica por VPA debemos descartar estas alteraciones metabólicas subyacentes. No existen evidencias de que los FAC de tercera generación provoquen alteraciones en las enzimas del ciclo de la urea.
- Alteraciones hormonales hipofisarias: existen evidencias de la existencia de alteraciones endocrinológicas a nivel hipofisario en pacientes menores de 25 años en tratamiento con VPA cuya consecuencia es una anovulación androgénica crónica que se cree inducida o facilitada por el tratamiento anticrisis y que se expresa clínicamente con el síndrome de ovario poliquístico (SOP).
EPILEPSIA Y ENFERMEDAD RENAL90
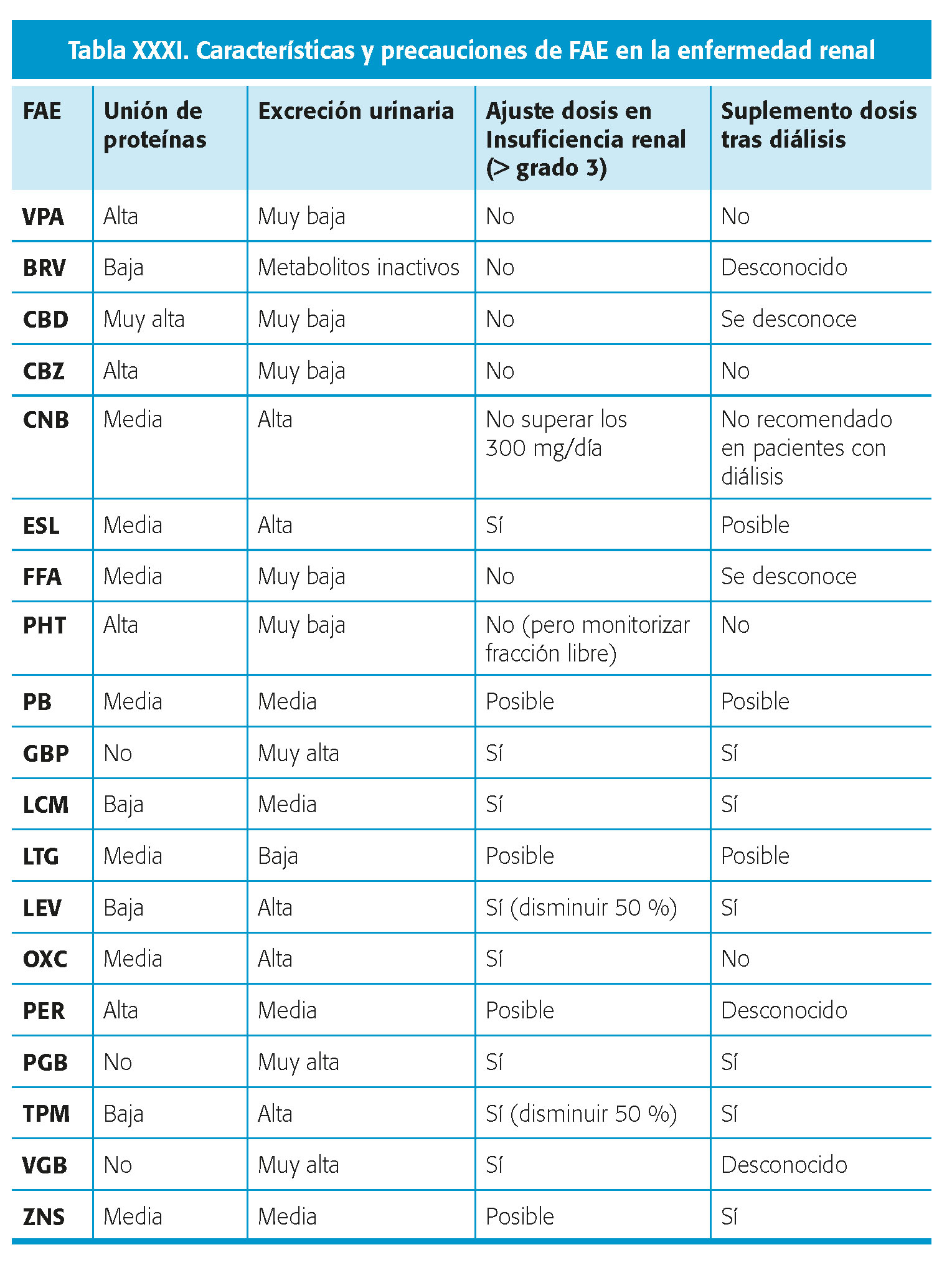
La disminución de la excreción renal puede llevar a toxicidad por disminución de la eliminación de FAC.
Hay que tener en cuenta el posible aclaramiento del FAC durante la hemodiálisis. Algunos FAC precisan suplemento de dosis tras la diálisis.
La hipoalbuminemia es prevalente en la enfermedad renal y puede producir un aumento de la concentración libre de los FAC con alta unión a proteínas como PHT y VPA.
Se han descrito EA de toxicidad renal, incluyendo alteraciones iónicas, con casi todos los FAC. Se deben evitar específicamente TPM y ZNS en pacientes con nefrolitiasis o posibilidad de desarrollarla.
En la tabla XXXI se resumen las principales precauciones de los FAC en relación a enfermedad renal.
EPILEPSIA Y TRASPLANTES91
Las crisis epilépticas son frecuentes en el paciente trasplantado, la mayoría en el periodo agudo peritrasplante. El mayor riesgo se observa tras el trasplante de hígado. La etiología es multifactorial.
Algunos inmunosupresores como tacrolimus, ciclosporina y OKT3 son neurotóxicos y pueden provocar crisis epilépticas.
Por otro lado, los FAC inductores enzimáticos se deben evitar ya que disminuyen los niveles de algunos inmunosupresores, principalmente ciclosporina, sirolimus, tacrolimus y posiblemente corticoides y el VPA puede aumentar los niveles de micofenolato por inhibición enzimática.
Busulfán puede producir crisis epilépticas en pacientes en los que se administra tras un trasplante de médula ósea.
Son FAC seguros por bajas o nulas interacciones farmacocinéticas: LEV, BRV, LCM, GBP, PGB, VGB.
EPILEPSIA Y ENFERMEDADES INFECCIOSAS84,92,93
Existen numerosos fármacos antiinfecciosos que pueden interaccionar con los FAC. Así:
- Los carbapenémicos disminuyen las concentraciones de VPA.
- Claritromicina, eritromicina, fluconazol, ketoconazol aumentan los niveles de CBZ.
- En el tratamiento de la tuberculosis, la isoniazida inhibe el metabolismo de CBZ, PHT y VPA provocando aumento de dosis de estos fármacos. Al contrario, la rifampicina disminuye el aumento de las concentraciones plasmáticas de CBZ, LTG, PB, PHT y VPA.
- Algunos inhibidores de las proteasas (IP) e inhibidores no nucleósidos de la transcriptasa inversa (INNTI) pueden aumentar los niveles de PHT, VPA y LTG por desplazamiento en la unión a proteínas plasmáticas y/o inhibición del metabolismo hepático.
- El tratamiento para el VIH con lopinavir/atazanavir requiere aumento de dosis de Los pacientes con VIH en tratamiento con VPA requieren disminuir las dosis de zidovudina.
Por otro lado, también los FAC pueden afectar a los antiinfecciosos. Por ejemplo, los inductores disminuyen la concentración de praziquantel y albendazol utilizados para el tratamiento de la neurocisticercosis o de los fármacos antirretrovirales. Algunos antibióticos favorecen la aparición de crisis epilépticas. Nivel de evidencia III-IV: penicilinas, cefalosporinas, quinolonas y carbapenémicos. De especial interés es el estatus no convulsivo en pacientes en tratamiento con cefalosporinas.
EPILEPSIA, DISCAPACIDAD MENTAL Y DETERIORO COGNITIVO94-96
En este grupo de pacientes se recomiendan FAC que no produzcan trastornos de conducta y desinhibición: CBZ, OXC, ESL, LTG, VPA. Por el contrario, se deben evitar FAC con mayor riesgo de agresividad y trastorno de conducta: LEV, PER, PB, TGB, TPM, VGB, ZNS.
Por otro lado, se deben evitar fármacos que puedan empeorar la función cognitiva: BZD, PB, PHT, TPM. La politerapia puede contribuir al empeoramiento cognitivo.
GBP y LTG están consideradas como tratamiento seguro en paciente con epilepsia y discapacidad intelectual. Nivel de evidencia III.
Aunque el TPM puede producir efectos psiquiátricos en población epiléptica general, hay evidencia nivel I-II de que TPM es efectivo en el control de crisis y no produce un impacto negativo en comportamiento ni en calidad de vida en pacientes con epilepsia y discapacidad intelectual (no se ha estudiado específicamente la función cognitiva).
No hay evidencia sobre una eficacia mayor en el control de crisis en la enfermedad de Alzheimer entre los distintos FAC.
Con muy baja evidencia en la enfermedad de Alzheimer LEV podría mejorar la cognición, pero empeorar el ánimo, LTG empeorar la cognición, pero mejorar la depresión y PB empeorar ambas.
EPILEPSIA E INTERVENCIONES QUIRÚRGICAS
En general no se contraindica la anestesia general en pacientes con epilepsia.
Asegurar la administración del FAC: vía oral previo a la cirugía y en cuanto se tolere la vía oral, o en forma parenteral si es posible. En el caso de FAC sin presentación parenteral y necesidad de ayuno prolongado, sustituir el FAC habitual por otro parenteral, con dosis de carga y posterior mantenimiento hasta que pueda administrarse por vía oral.
Tener en cuenta posibles alteraciones de farmacocinética por interacciones de FAC con otros fármacos.
Bibliografía
- Taylor RS, Sander JW, Taylor RJ, Baker GA. Predictors of health-related quality of life and costs in adults with epilepsy: a systematic Epilepsia. 2011; 52: 2168-80.
- Keezer MR, Bell GS, Neligan A, Novy J, Sander Cause of death and predictors of mortality in a community-based cohort of people with epilepsy. 2016; 86(8): 704-12.
- Forsgren L, Bucht G, Eriksson S, Bergmark Incidence and clinical characterization of unprovoked seizures in adults: a prospective population-based study. Epilepsia. 1996; 37(3): 224-9.
- Gilad R, Boaz M, Dabby R, Sadeh M, Lampl Y. Are post intracerebral hemorrhage seizures prevented by anti-epileptic treatment? Epilepsy 2011; 95(3): 227-31.
- Jin J, Chen R, Xiao Post-epilepsy stroke: a review. Expert Rev Neurother. 2016; 16(3): 341-9.
- Serrano-Castro PJ, Fernández-Pérez J, López-González FJ, Toledo-Argany M, Estévez-María JC, Arjona-Padillo A, et Eslicarbazepine acetate and carotid intima-media thickness in epileptic patients. Epilepsy Res. 2017; 138: 81-7.
- Ruiz-Giménez J, Sánchez-Alvarez JC, Cañadillas-Hidalgo F, Serrano-Castro Antiepileptic treatment in patients with epilepsy and other comorbidities. Seizure. 2010; 19(7): 375-82.
- Chen WB, Gao R, Su YY, Zhao JW, Zhang YZ, Wang L, et Valproate vs. diazepam for generalized convulsive status epilepticus: a pilot study. Eur J Neurol. 2011; 18(12): 1391-6.
- Malow BA, Foldvary-Schaefer N, Vaughn BV, Selwa LM, Chervin RD, Weatherwax KJ, et al. Treating obstructive sleep apnea in adults with epilepsy: a randomized pilot trial. 2008: 19;71(8): 572-7.
- Souverein PC, Webb DJ, Weil JG, Van Staa TP, Egberts AC. Use of antiepileptic drugs and risk of fractures: case-control study among patients with epilepsy. 2006; 66: 1318-24.
- Herzog AG, Drislane FW, Schomer DL, Pennell PB, Bromfield EB, Dworetzky BA, et Differential effects of antiepileptic drugs on sexual function and hormones in men with epilepsy. Neurology. 2005; 65: 1016-20.
- Shih F-Y, Chuang Y-C, Chuang M-J, Lu Y-T, Tsai W-C, Fu T-Y, et al. Effects of antiepileptic drugs on thyroid hormone function in epilepsy Seizure; 2017; 48: 7-10.
- Bansal AD, Hill CE, Berns JS. Use of antiepileptic drugs in patients with chronic kidney disease and end stage renal Seminars in Dialysis. 2015; 28(4): 404-12.
- Asconape JJ. Pharmacokinetic considerations with the use of antiepileptic drugs in patients with HIV and organ Curr Neurol Neurosci Rep. 2018; 18: 89.
- Sutter R, Rüegg S, Tschudin-Sutter S. Seizures as adverse events of antibiotic drugs: A systematic Neurology. 2015; 85(15): 1332-41.
- Birbeck GL, French JA, Perucca E, Simpson DM, Fraimow H, George JM, et al. Antiepileptic drug selection for people with HIV/AIDS: evidence-based guidelines from the ILAE and Epilepsia. 2012; 53: 207-14.
- Brodie MJ, Besag F, Ettinger AB, Mula M, Gobbi G, Comai S, et al. Epilepsy, antiepileptic drugs, and aggression: an evidence-based Pharmacol Rev. 2016; 68: 563-602.
- Doran Z, Shankar R, Keezer MR, Dale C, McLean B, Kerr MP, et Managing anti-epileptic drug treatment in adult patients with intellectual disability: a serious conundrum. Eur J Neurol. 2016; 23(7): 1152-7.
- Liu J, Wang LN, Wu LY, Wang YP. Treatment of epilepsy for people with Alzheimer´s Cochrane Database Syst Rev. 2018;(12):CD011922.

