INTRODUCCIÓN
El manejo de la mujer con epilepsia (MCE) requiere estrategias que tengan en cuenta el control de las CE, los efectos secundarios de los FAE y el efecto de las hormonas sexuales sobre las CE en sus diferentes momentos vitales; así como el impacto de la epilepsia y de los FAE sobre su bienestar reproductivo y calidad de vida.
FERTILIDAD Y SEXUALIDAD
En las MCE se describe una mayor tasa de infertilidad y de disfunción sexual respecto a la población general. Nivel de evidencia III. Esto se relaciona con: factores psicosociales, la fisiopatología de la epilepsia y los FAE empleados. Se ha observado sobre todo en ER del lóbulo temporal y con el uso de politerapia y FAE inductores enzimáticos (FAE-IE)38-40. Se ha descrito una mayor incidencia de amenorrea hipotalámica, hiperprolactinemia funcional, síndrome de ovario poliquístico (SOP) y fallo ovárico prematuro. La prevalencia del SOP es mayor en tratadas con VPA sobre todo si éste se inició antes de los 20 años; en cuyo caso el efecto suele ser reversible. Nivel de evidencia III.
Las técnicas de reproducción asistida forman parte del tratamiento de los trastornos de la fertilidad. A menudo requiere la estimulación ovárica con gonadotrofinas, llevando un aumento significativo y brusco de los niveles de estrógeno. Además, suelen precisar la administración de estrógenos para la preparación endometrial posterior. Todo ello podría empeorar el control de las CE sobre todo en tratadas con LTG41. Nivel de evidencia IV.
EPILEPSIA CATAMENIAL
Hablaremos de epilepsia catamenial (EC) ante un aumento al menos del doble en la frecuencia de las crisis durante una fase específica de ciclo menstrual (CM)38,39,42. Uno de los factores clave sería las variaciones en los niveles de estrógenos (proconvulsivante) y progesterona (anticonvulsivante) durante el mismo39. Nivel de evidencia III.
Considerando día 1 el primero de la menstruación y 14 el de la ovulación, se describen tres posibles patrones: C1: perimenstrual (del día -3 al 3), C2: periovulación (del 10 al 16) y C3: ciclo anovulatorio (del día 10 al -4 del ciclo siguiente).
En MCE con menstruaciones regulares se pueden plantear tratamientos hormonales o no hormonales. Nivel de evidencia IV. La progesterona ha demostrado ser útil cuando hay una exacerbación de la crisis, mayor de 3 veces, en el periodo C1. Nivel de evidencia II. En mujeres con ciclos irregulares podría valorarse medroxiprogesterona o ACO. Nivel de evidencia IV. Siempre hay que considerar los riesgos y efectos secundarios de los distintos fármacos39 (tabla XVII).

MANEJO DURANTE LA EDAD FERTIL
Es importante el manejo individualizado y multidisciplinar (neurólogos y ginecólogos) considerando el momento vital de la mujer, sus características (enfermedad, FAE, antecedentes personales y obstétricos) y sus preferencias, sobre todo de cara a planificar el embarazo minimizando los posibles riesgos para ella y el feto43 (tabla XVIII).
Dar ácido fólico desde al menos un mes antes de la gestación y manteniéndolo los primeros meses ha demostrado, en la población general, una reducción del riesgo de malformaciones congénitas mayores (MCM) sobre todo defectos del tubo neural. Nivel de evidencia II. Además, en MCE ha mostrado una reducción del riesgo de abortos espontáneos y beneficios sobre el neurodesarrollo y el lenguaje39,43.
VPA está contraindicado en mujeres con capacidad para concebir en España (excepto que se cumplan las condiciones del Programa de Prevención de Embarazos)24.

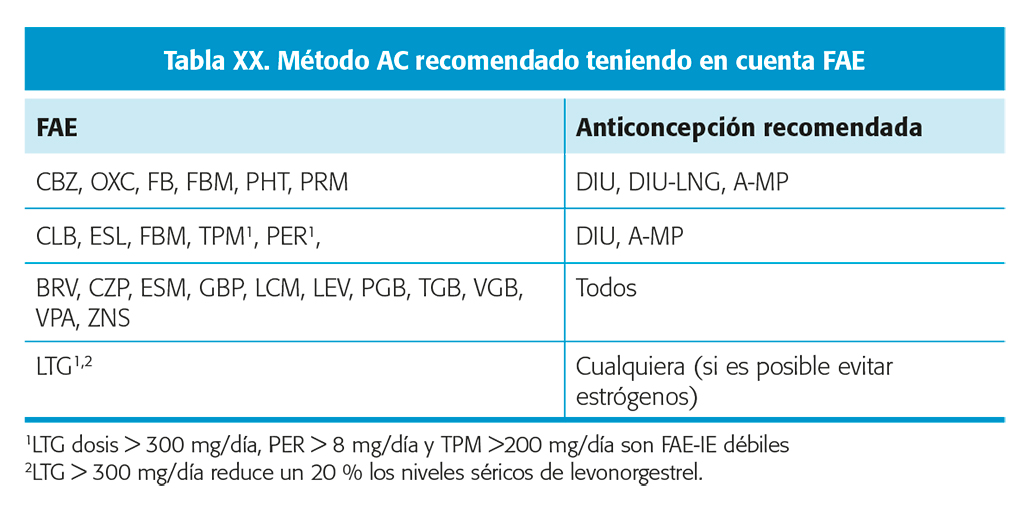
ANTICONCEPCIÓN (TABLAS XIX Y XX)
En MCE, la mitad de los embarazos no son programados y muchas, especialmente las más jóvenes, utilizan métodos anticonceptivos (AC) de baja eficacia40. Nivel de evidencia II.
No existe clara evidencia de que los anticonceptivos hormonales (ACH) interfieran en el control de la epilepsia, pero sí que aquellos que contienen estrógenos puede reducir de forma muy significativa los niveles de LTG (hasta un 50 %, gran variabilidad interindividual) y llevar a una pérdida del control de las crisis. Nivel de evidencia II. Esta interacción se puede observar, pero en menor medida con VPA, OXC y ESL39 (tabla XIX).
Los FAE-IE interaccionan con los ACH reduciendo su eficacia. Nivel de evidencia III. No se observa interacción con el DIU levonorgestrel (DIU-LNG) por su acción local que sólo induce cambios en endometrio y en mucosa del cérvix. El acetato de medroxiprogesterona tampoco ha mostrado interacción significativa44. Teóricamente los FAE-IE pueden reducir la eficacia del implante de progesterona39.
Los FAE-IE también interacciona con la AC de emergencia. En estos casos, el método de elección sería el DIU. De no ser posible se puede proponer, aunque sin suficiente evidencia, utilizar dosis doble de la píldora postcoital44.

Embarazo (tabla XXI)
Riesgos obstétricos y control de crisis
La mayoría de las MCE tiene embarazo, parto y descendencia normales. Nivel de evidencia II. Sólo un 15-37 % sufre un incremento de la frecuencia de crisis que se relaciona con incumplimiento terapéutico, cambios farmacocinéticos de los FAE y deprivación de sueño40,43. La probabilidad de continuar libre de crisis durante el embarazo viene determinada por el hecho de haberlo estado los 9-12 meses previos al mismo40. Nivel de evidencia II.
Las MCE presentan un mayor riesgo de muerte materna (x10) y de complicaciones obstétricas (parto prematuro, cesárea y preeclampsia)40. Nivel de evidencia II. El neonato tiene un pequeño pero mayor riesgo de ser pequeño para la edad gestacional, de bajo peso al nacer y de ingresos en la unidad neonatal40,42,43. En un estudio realizado en países escandinavos entre 1996 y 2017, presentado en la AES de di¬ciembre de 202245, el riesgo de bajo peso al nacer se incrementó con el uso durante el embarazo de carbamacepina (OR: 1,44, IC 95 %: 1,21-1,71), oxcarbacepina (OR: 1,32, IC 95 %: 1,03-1,69), topiramato (OR: 1,60, IC 95 %: 1,15-2,24), pregabalina (OR: 1,23, IC 95 %: 1,02-1,48), y clobazam (OR: 4,36, IC 95 %: 1,66-11,45). El uso de zonisamida y fenobarbital se ha asociado también a bajo peso al nacer, aunque en estudios más pequeños. La lamotrigina, por el contrario, no se ha asociado a cambios en el peso del neonato. No hay evidencias que apoyen el aumento de complicaciones hemorrágicas durante el parto ni en el recién nacido de MCE, por lo que no está indicada la vitamina K oral a la madre previa al parto46.
Durante el embarazo, con gran variabilidad interindividual, se incrementa el aclaramiento de PTH, CBZ, LTG, OXC, LEV y ZNS; por lo que se aconseja monitorizar sus niveles (preferible la fracción libre en los ligados a proteínas). Nivel de evidencia II40,47. Una reducción mayor del 35 % respecto a los preembarazo se ha asociado a un empeoramiento en el control de las crisis; hecho particularmente importante con LTG40,43. Nivel de evidencia II. Se aconseja mantenerlos al menos por encima del 65 % de los basales, desde el primer trimestre. Si durante el embarazo hemos aumentado la dosis de FAE hay riesgo de toxicidad en el postparto; hecho importante para LTG al aparecer pronto los síntomas (inestabilidad /diplopía)42.

En el puerperio hay riesgo de empeoramiento en el control de las crisis debido, sobre todo, a privación de sueño por lo que se aconseja tener precauciones especiales como usar arnés en caso de mioclonías o carritos si hay riesgo de caídas, cambiar al niño en un lugar seguro y evitar bañarlo sola o dormir con él en la cama43,44. Nivel de evidencia IV.
Malformaciones fetales (MF)
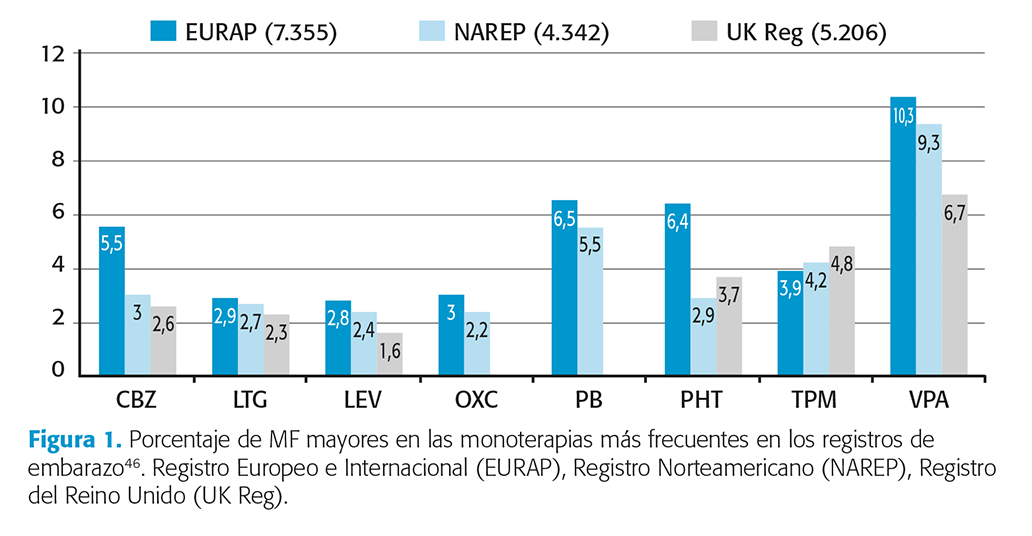
El uso de FAE durante el embarazo se asocia a un aumento del riesgo de MF pasando del 1-3 % al 4-9 %. Las más comunes son las cardiacas (defectos septales), las hendiduras faciales (labio leporino), las genitourinarias (hipospadias, agenesias renales), las esqueléticas (agenesias, hipoplasias, pie equino) y los defectos del tubo neural (espina bífida)40. La mayoría se producen los primeros 28-70 días posconcepción, siendo factor de riesgo el antecedente familiar de primer grado de MF39,44,48. Nivel de evidencia II. En los diferentes registros VPA es el que comporta un mayor riesgo y LTG es el de menor riesgo, seguido de LEV (fig. 1); siendo dosis dependiente para la mayoría de FAE48. Nivel de evidencia II.
Las MF asociadas a VPA incluyen un amplio abanico (espina bífida, defectos septales, hipospadias y hendiduras faciales). Las asociadas a PB son principalmente cardiacas y de la hendidura facial; siendo estas últimas las más descritas para TPM40,49.
La politerapia parece aumentar el riesgo fundamentalmente cuando incluye VPA, TPM, PB y posiblemente CBZ, siendo el efecto dosis dependiente40,42,44. Nivel de evidencia III. No hay datos suficientes de politerapia con otras combinaciones. Ante los escasos datos LCM, ESL, PER y BRV, éstos sólo deben utilizarse durante el embarazo cuando su beneficio para la madre se considere superior a los posibles riesgos para el feto.
Un análisis de la estructura50 predice un riesgo alto de teratogenia con perampanel (0,80) y rufinamida (0,75). Los estudios animales en ratas y conejos han mostrado elevado riesgo de anomalías viscerales y esqueléticas, así como reducción de peso neonatal y muerte del embrión o el feto con la administración de perampanel, y de anomalías esqueléticas, bajo peso neonatal y muerte del embrión o feto con rufinamida. En cuanto al brivaracetam, el riesgo que predice el modelo es mode¬rado (0,50). En los modelos animales, el brivaracetam se ha asociado a un riesgo moderado de reducción de peso neonatal y de muerte del embrión o el feto, y se han comunicado dos casos de malformaciones menores en hijos de mujeres que tomaron brivaracetam durante el embarazo. El modelo predice un riesgo bajo de teratogenia asociado a oxcarbacepina, gabapentina y lacosamida. Los resultados de este análisis son concordantes con la experiencia clínica, asignando un elevado ries¬go a la exposición a valproato, topiramato, fenobarbital y fenitoína, y un bajo riesgo con lamotrigina y levetiracetam, lo que da validez al modelo. No obstante, aunque los resultados del análisis pueden tener valor orientativo, no hay que olvidar que se trata de un modelo predictivo, por lo que se deben tomar con precaución. El riesgo de teratogenia asociada a fármacos se incrementa cuando se asocian otros factores como: edad de la madre mayor de 31 años, antecedentes familiares de malformaciones fetales y concepción tras fertilización asistida51. Cuando se ha pro¬ducido una malformación fetal en un primer embarazo con exposición a un fármaco, el riesgo de malformaciones en embarazos sucesivos se incrementa de forma significativa52.
Alteraciones cognitivo-conductuales
Estudios iniciales, la mayoría retrospectivos y no controlados, alertaban del riesgo de déficits cognitivos en hijos de madres que habían presentado más de 5 crisis convulsivas durante el embarazo, tomaban VPA o PB o estaban en politerapia. Estudios recientes muestran que los niños expuestos a VPA durante la gestación, tienen un coeficiente intelectual (CI) más bajo (hasta 10 puntos), con habilidades verbales y no verbales, memoria y funciones ejecutivas más pobres respecto a los expuestos a LTG, PTH, CBZ, LEV o TPM aunque este último con un menor número de casos53,54. El efecto es dosis-dependiente, aunque los expuestos a < 800 mg/día de VPA también tuvieron menos habilidades verbales y precisaron más ayuda escolar que los controles. Nivel de evidencia II. También se ha detectado en los expuestos a VPA, mayor riesgo de déficit de atención/hiperactividad, trastorno del espectro autista (x 3) y de autismo (x 5) y peores resultados en las escalas adaptativas39,42,55. Nivel de evidencia II.
En un estudio basado en el registro nórdico56, que incluyó datos de 4.494.296 recién nacidos tras exposición intraútero a fármacos antiepilépticos, sufrieron trastorno de espectro autista un 4,3 % de los expuestos a topiramato y un 2,7 % de los expuestos a valproato. Además, un 3,1 % de los expuestos a topiramato y un 2,4 % de los ex¬puestos a valproato presentaron discapacidad intelectual. El índice de riesgo (hazard ratio) ajustado de sufrir trastorno de espectro autista y de discapacidad intelectual tras exposición a topiramato fue de 2,8 (IC 95 %: 1,4-5,7) y de 3,5 (IC 95 %: 1,4-8,6) y tras la exposición a valproato de 2,4 (IC 95 %: 1,7-3,3) y 2,5 (IC 95 %: 1,7-3,7) res¬pectivamente. Aunque ninguna dosis de estos fármacos es segura, sí que se encuen¬tra una relación entre dosis y riesgo de alteración en el neurodesarrollo. El índice de riesgo ajustado fue de 1,7 (IC 95 %: 1,0-2,8) con dosis de topiramato inferiores a 100 mg/día y de 2,9 (IC 95 %: 1,3-6,7) para dosis superiores. En cuanto al valproato, el índice de riesgo ajustado de sufrir alteración en el neurodesarrollo fue de 2,3 (IC 95 %: 1,9-2,8) para dosis inferiores a 750 mg/día y de 5,6 (IC 95 %: 4,7-68) para dosis superiores. No se apreció incremento de riesgo consistente de alteración en el neurodesarrollo con la exposición intraútero en monoterapia de lamotrigina, le¬vetiracetam, carbamacepina, oxcarbacepina, gapapentina, pregabalina, clonacepam, ni fenobarbital. Sin embargo, sí hubo un incremento de riesgo con las biterapias de levetiracetam con carbamacepina y lamotrigina con topiramato.
Lactancia materna
Debido a sus beneficios tanto para el desarrollo del niño como para la salud de la madre la OMS recomienda la lactancia materna a todas las mujeres los primeros 6 meses. Además, en hijos de mujeres epilépticas ha mostrado mejores puntuaciones en habilidades motoras y sociales, así como un mayor CI40,44,47.
La mayoría de los FAE son seguros durante la lactancia materna, aunque conviene asesorar individualmente valorando riesgo-beneficio. Nivel de evidencia IV. El paso significativo de los FAE a través de la leche materna se relaciona con: una elevada concentración en el plasma de la madre, una baja unión a proteínas y una alta solubilidad56. Nivel de evidencia III (tabla XXII).

Bibliografía
- Harden CL, Pennell PB. Neuroendocrine considerations in the treatment of men and women with Lancet Neurol. 2013; 12: 72-83.
- Sazgar M. Treatment of women with epilepsy. Continuum (Minneap Minn). 2019; 25(2): 408-30.
- Harden C, Lus Epilepsy in Pregnancy. Neurol Clin. 2019; 37: 53-62.
- Mostacci B, Esposto R, Lello S, Bisulli F, Licchetta L, Tinuper P. Estrogen-related seizure exacerbation following hormone therapy for assisted reproduction in women with Seizure. 2018; 61: 200-2.
- Voinescu PE, Pennell Delivery of a personalized treatment approach to women with epilepsy. Semin Neurol. 2017; 37: 611-23.
- Husebye ESN, Gilhus NE, Riedel B, Spigset O, Daltveit AK, Bjørk Verbal abilities in children of mothers with epilepsy: association to maternal folate status. Neurology. 2018; 91(9): e811-21.
- Epilepsy in pregnancy. www.rcog.org.uk Acceso 26 de mayo del 2019
- Christensen J, Bjørk MH, Dreier J, Gilhus N, Gissler M, Igland J, et al. Prenatal Exposure to Antiseizure Medication and Birth Weight Outcomes. En: AES 2022 Annual Meeting, [Internet]; 2-6 de diciembre de 2022; Nashville, Estados Unidos. Disponible en: https://cms.aesnet.org/abstractslisting/prenatal-exposure-to-antiseizure-medication-and-birth-weight-outcomes.
- Panchaud A, Choen JM, Patorno E. Anticonvulsants and the risk of perinatal bleeding complicatios: a pregnancy cohort Neurology. 2018; 91: e533-e42
- Voinescu PE, Park S, Chen LQ, Stowe ZN, Newport DJ, Ritchie JC, et al. Antiepileptic drug clerances during pregnancy and clinical implications for women with epilepsy. 2018; 91(13): e1228-36.
- Tomson T, Battino D, Bonizzoni E, Craig J, Lindhout D, Perucca E, et al.; and for the EURAP study group. Comparative risk of major congenital malformations with eight different antiepileptic drugs: a prospective cohort study of the EURAP Lancet Neurol. 2018; 17(6): 530-8.
- Hernadez-Diaz S, Huybrechts KF, Desai RJ, Cohen JM, Mogun H, Pennell PB, et al. Topiramate use early in pregnancy and the risk of oral Neurology. 2018; 90: e1-e10.
- Kang L, Duan Y, Chen C, Li S, Li M, Chen L, et al. Structure-Activity Relationship (SAR) Model for Predicting Teratogenic Risk of Antiseizure Medications in Pregnancy by Using Support Vector Machine. Front Pharmacol. 2022 Feb 25;13:747935.
- Vajda FJE, O’Brien TJ, Graham JE, Hitchcock AA, Lander CM, Eadie MJ. The contri¬bution of non-drug factors to fetal malformation in anti-seizure-medication-treated pregnancy. Epilepsy Behav. 2021 May;118:107941.
- Vajda F, O’Brien T, Graham J, Hitchcock A, Perucca P, Lander C, et al. Fetal malforma¬tions in successive pregnancies in Australian women with epilepsy. Epilepsy Behav. 2022 Sep;134:108848.
- Baker G, Bromley R, Briggs M, Cheyne CP, Cohen MJ, García-Fiñana M, et al. IQ at 6 years after in utero exposure to antiepileptic drugs. A controled cohort study. Neuro 2015; 84: 382-90.
- Bromley R, Calderbank R, Cheyne CP, Rooney CL, Trayner Cl, Clayton-Smith J, et al. Cognition in school-age children exposed to levetirazetam, topiramate, or sodium Neurology. 2016; 87: 1943-53.
- Christense J, Koops T, Sorensen J, Shendel D, Thorlund E, Pedersen LH, Et al. Prenatal Valproate exposure and risk of Autism spectrum disorders and childhood Autism. JAMA 2013; 309 (16): 1696-703.
- Bjørk MH, Zoega H, Leinonen MK, Cohen JM, Dreier JW, Furu K, et al. Association of Prenatal Exposure to Antiseizure Medication With Risk of Autism and Intellectual Disability. JAMA Neurol. 2022 Jul 1;79(7):672-681. Erratum in: JAMA Neurol. 2022 Jul 1;79(7):727.

