TRATAMIENTO ANTICRISIS CRÓNICO EN LA INFANCIA
Selección del fármaco anticrisis en epilepsia infantil
El fármaco anticrisis (FAC) ideal en la edad pediátrica es aquel capaz de eliminar las crisis sin producir efectos adversos (EA) importantes, es decir respetando la calidad de vida del niño con epilepsia. Entre las características ideales se incluyen1,2: posible administración por vía oral y por vía parenteral, formulación cómoda y sencilla para el niño (disponibilidad de suspensión oral), absorción completa y no modificable por la toma de fármacos o alimentos, vida media prolongada (una toma única al día), cinética lineal predecible, mínima unión a proteínas plasmáticas, ausencia de interacción con otros fármacos, rango terapéutico alto (amplio margen de dosis), posibilidad de dosificar en mg/kg/día, que no produzca tolerancia ni adición, ausencia de EA graves, que no produzca deterioro cognitivo ni conductual, que no empeore ningún tipo de crisis, amplio espectro terapéutico y adecuado balance entre eficacia y tolerabilidad.
En este capítulo se revisan las opciones terapéuticas disponibles y la evidencia científica actual para el tratamiento de la epilepsia en la edad pediátrica. Es importante destacar que, en el grupo de los menores de 4 años, existe una información muy limitada sobre la eficacia real de los FAC, debido al bajo número de estudios aleatorizados controlados y al aún más escaso número de metanálisis3.
Evidencia sobre el tratamiento de inicio con fármacos anticrisis en la epilepsia con crisis focales, con o sin generalización secundaria, en niños (tabla I)
La práctica totalidad de los estudios de evidencia se refieren a niños mayores de 4 años y adolescentes y casi no existen referencias para el grupo de niños menores de 4 años3,4-9. Existe información sobre el empleo de FAC como PB, PHT, CBZ, OXC, VPA, CLB, LTG, TPM, LCM, LEV y GBP. Algunos estudios incluyen tanto niños como adultos9. En la mayoría de los ensayos, los pacientes son aleatorizados a CBZ, PHT, PB, VPA, LTG u OXC. El FAC más comúnmente analizado en este grupo es CBZ, seguido por VPA y PHT.
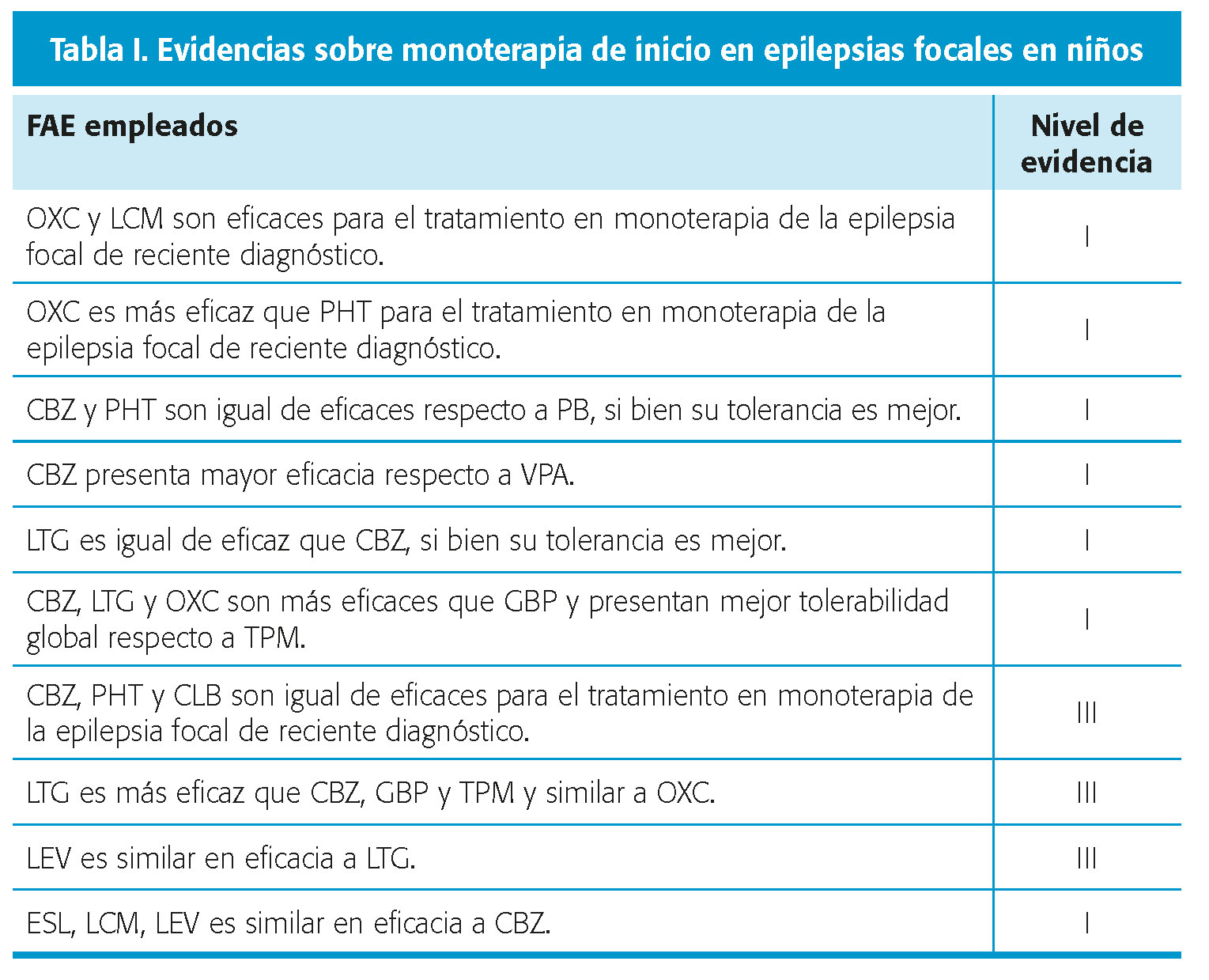
Evidencias sobre terapia añadida en epilepsias focales refractarias en niños (tabla II)
En este grupo, tenemos estudios de evidencia para FAC como OXC, LTG, TPM, LEV, GBP, LCM, RFM, ESL, ZNS, PER y BRV4-7,9,10.
Los estudios de extrapolación sobre el empleo de FAC de tercera generación para epilepsias focales en niños concluyen que, en niños mayores de 4 años, la farmacocinética, la semiología de las crisis, el patrón de EEG y la etiología de las crisis son iguales a las propias del adulto, y se puede inferir una similar tasa de respuesta y de tolerabilidad de los FAC para este grupo poblacional11. Sin embargo, esta extrapolación no es aplicable al grupo de menores de 4 años, principalmente para los menores de 2 años, dado los distintos patrones electro-clínicos de crisis, el perfil de efectos adversos, las diferentes etiologías de epilepsia, y la peculiar farmacocinética que tiene este grupo de edad.
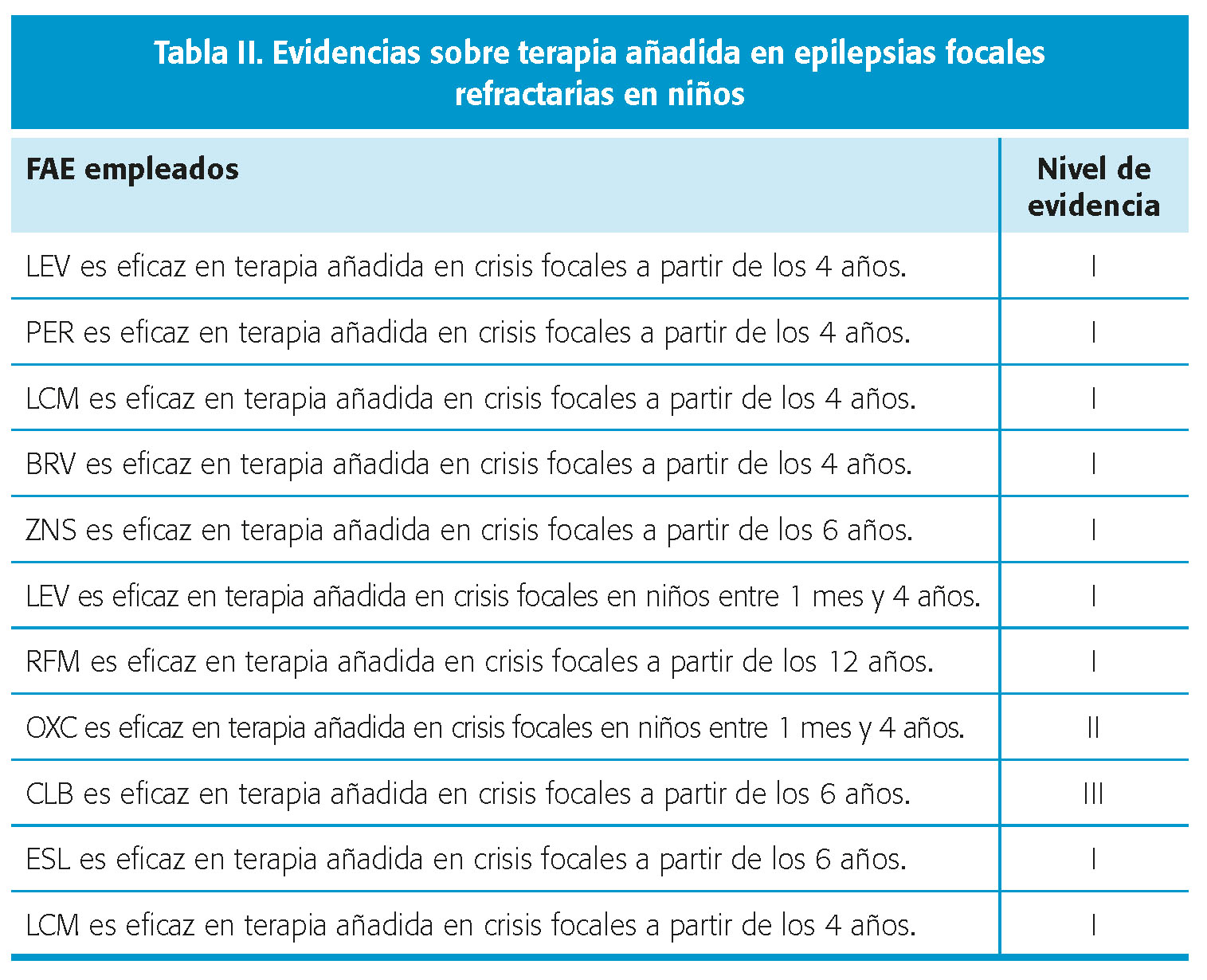
Evidencia sobre el tratamiento con FAC en la epilepsia rolándica infantil de curso autolimitado (EBI-R) en niños preescolares y escolares (tabla III)
En este grupo de pacientes, no suele ser necesario tratar con FAC, dado el curso autolimitado de este síndrome4,5,7. Existe información limitada sobre la evidencia de FAC como CBZ, OXC, VPA, LEV, LTG y GBP.
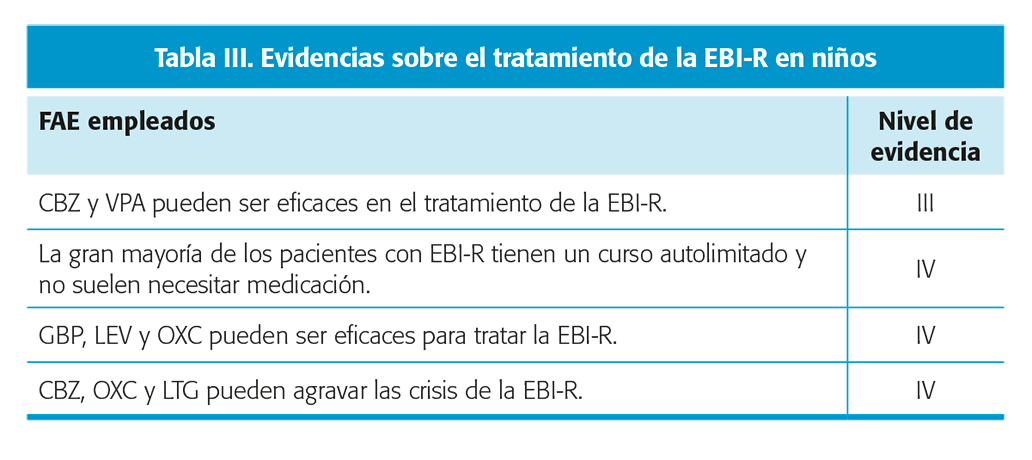
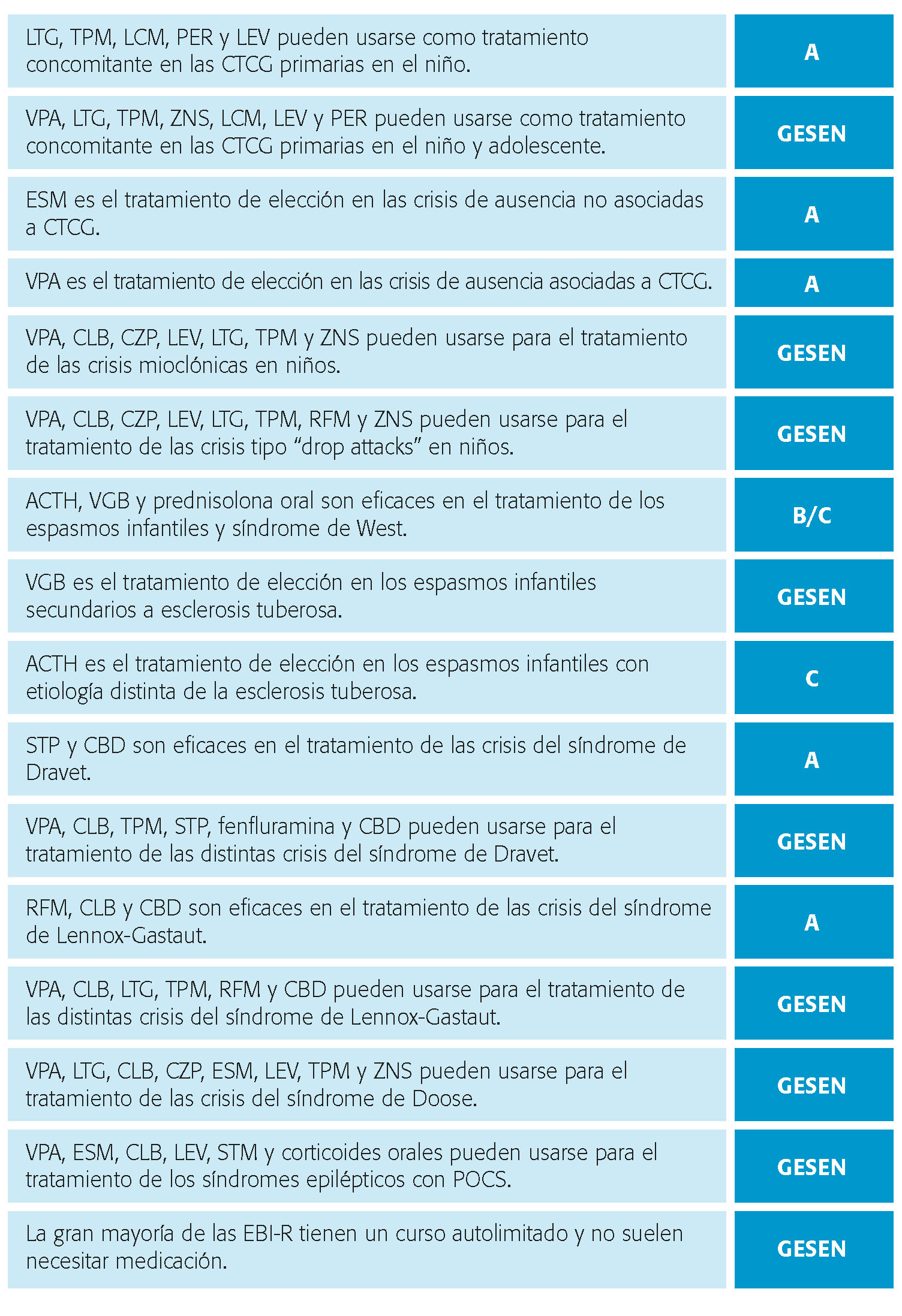
Evidencia sobre el tratamiento de las crisis tónico-clónicas generalizadas (CTCG) primarias en niños y adolescentes (tabla IV)
Existe muy escasa evidencia en niños, aunque ésta es algo más sólida entre la población adolescente3-10. Se han utilizado muy distintos FAC para este tipo de crisis, incluyendo VPA, LTG, LEV, TPM, PER, ZNS, CBZ, OXC, PB, PHT, CZP, CLB y FBM. En enero de 2020, LCM obtuvo la aprobación de la Agencia Europea del Medicamento (EMA) para el tratamiento adyuvante de las crisis primariamente generalizadas tónico-clónicas en niños y adolescentes a partir de los 4 años.

Evidencia sobre el tratamiento de las crisis de ausencia en niños (tabla V)
Existe evidencia definida principalmente por la comparación entre VPA, ESM y LTG4-8. Entre los FAC usados para este tipo de crisis, se incluyen VPA, ESM, LTG, TPM, ZNS, CLZ, CLB y LEV.

Evidencia sobre el tratamiento de las crisis mioclónicas en niños y adolescentes (tabla VI)
Existe una evidencia muy limitada tanto para niños como para adolescentes4-8,12. Entre los FAC usados para este tipo de crisis, se incluyen VPA, LEV, CLZ, TPM, ZNS, CLB, ESM, PRM, LTG y PER.

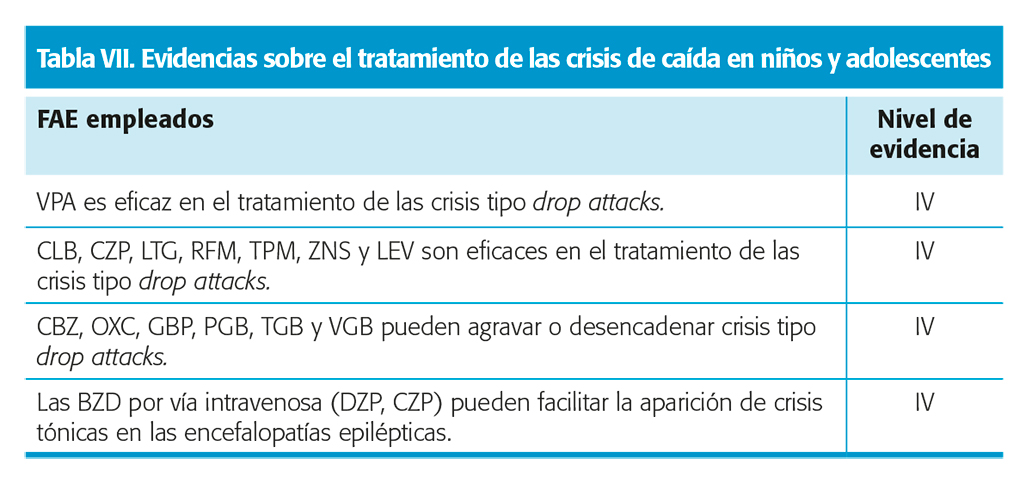
Evidencia sobre el tratamiento de las crisis de caída tipo drop-attacks (crisis tónicas y crisis atónicas) en niños y adolescentes (tabla VII)
Casi toda la información sobre evidencia en este tipo de crisis proviene de estudios en epilepsias frontales y en el síndrome de Lennox-Gastaut4-7. Entre los FAC usados para este tipo de crisis, se incluyen VPA, LTG, RFM, CLB, CZP, LEV, TPM y ZNS.
Evidencia sobre el tratamiento de las crisis de las epilepsias fotosensibles (tabla VIII)
La evidencia es muy limitada en este grupo de crisis7,13. Aparte de las medidas de protección frente a estímulos luminosos desencadenantes, existe evidencia sobre el empleo de FAC como VPA, CLB, CZP, ESM, LTG, LEV, TPM y BRV.

Evidencia sobre el tratamiento de las crisis del síndrome de Dravet (Tabla IX)
Existe una evidencia creciente sobre la eficacia real de los distintos FAC que se usan en el síndrome deDravet3,5,7,14,15. Entre los FAC usados para tratar las crisis de este síndrome se incluyen VPA, CLB, CZP, TPM, STP, LEV, ESM, ZNS y CBD. En enero de 2021, la fenfluramina obtuvo la aprobación de la EMA como tratamiento adyuvante de las crisis convulsivas en el síndrome de Dravet en pacientes a partir de 2 años.

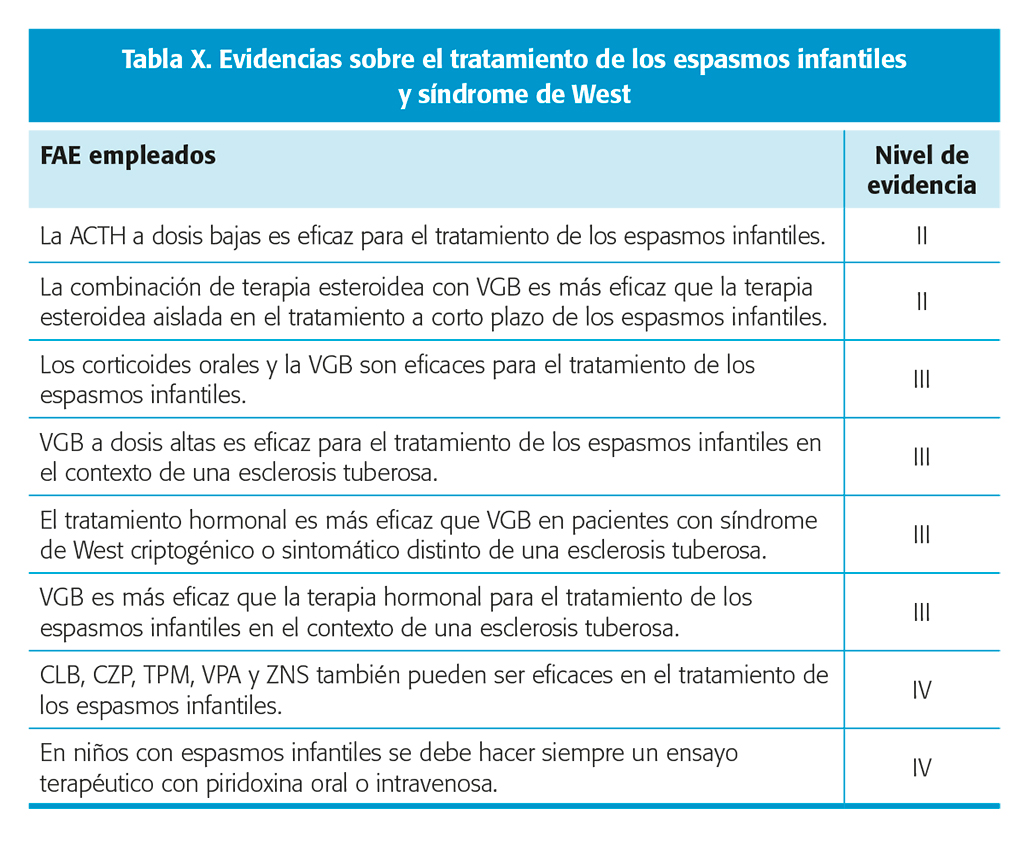
Evidencia sobre el tratamiento de los espasmos infantiles y Síndrome de West (tabla X)
Existe una evidencia derivada principalmente de los estudios comparativos entre VGB y terapia hormonal (ACTH/tetracosáctido intramusculares o bien corticoides orales como prednisolona o prednisona)3,5,7,16,17. Entre los fármacos usados para este tipo de crisis, se incluyen ACTH/tetracosáctido, corticoides orales, VGB, VPA, TPM, ZNS, CLB y CZP.
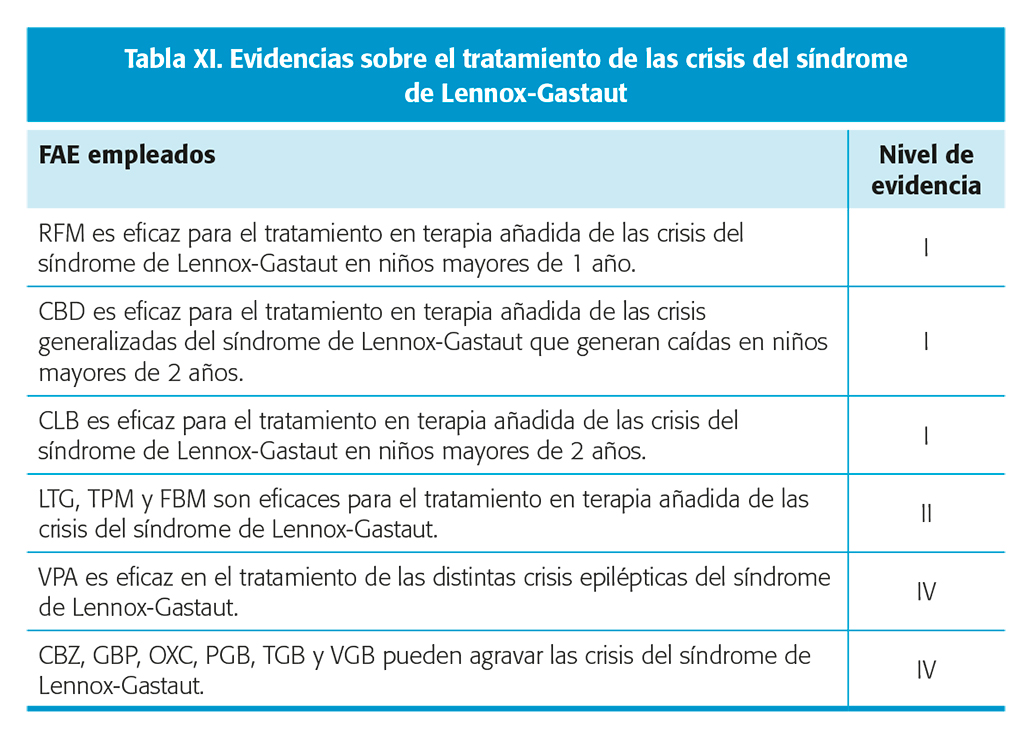
Evidencia sobre el tratamiento del Síndrome de Lennox-Gastaut (SLG) (tabla XI)
Existe una evidencia creciente sobre la eficacia de los distintos FAC que se usan en el SLG5,6,10,18-20. Entre los FAC empleados para tratar las crisis de este síndrome, se incluyen VPA, LTG, TPM, RFM, ZNS, CLB, CZP, ESM, FBM y CBD.
Evidencia sobre el tratamiento de las crisis del síndrome de Doose (tabla XII)
Existe muy escasa evidencia sobre la eficacia real de los distintos esquemas de tratamiento en este síndrome7,21. Entre los FAC usados para tratar las crisis del síndrome de Doose, se incluyen VPA, LTG, ESM, CZP, CLB, LEV, TPM y ZNS.

Evidencia sobre el tratamiento de las epilepsias pediátricas con punta- onda continua en sueño (POCS) (tabla XIII)
El objetivo del tratamiento no es tanto controlar las crisis, que suele conseguirse generalmente sin grandes dificultades, sino suprimir el patrón de POCS del EEG que suele ser altamente refractario. La evidencia sobre tratamientos en estas epilepsias es muy limitada7,22. Entre los fármacos usados para tratar estos síndromes se incluyen VPA, ESM, LEV, CLB, sultiame (STM) y corticoides orales.


TRATAMIENTO ANTICRISIS CRÓNICO EN EL ADULTO
En las últimas décadas el número de FAC disponibles ha aumentado exponencialmente, por lo que se dispone de múltiples opciones actualmente para el tratamiento crónico de la epilepsia una vez establecido su diagnóstico y la indicación de tratamiento. Tras confirmarse el diagnóstico clínico de epilepsia, se debe focalizar el esfuerzo en establecer un diagnóstico sindrómico lo más preciso posible de cara a dirigir el tratamiento anticrisis y, en caso necesario, el tratamiento específico de la etiología.
La primera opción deberá ser la monoterapia en todos los casos, ya que más de la mitad de los pacientes se mantendrá libre de crisis, y paralelamente se minimizan efectos adversos, y además se mejoran la adherencia al tratamiento y la calidad de vida de los pacientes23. Debe tenerse en cuenta que VPA está contraindicado en mujeres con capacidad para concebir (excepto que se cumplan las condiciones del Programa de Prevención de Embarazos)24.
En este capítulo se revisarán las opciones terapéuticas disponibles y la evidencia científica actual para el tratamiento de inicio de la epilepsia en adultos.
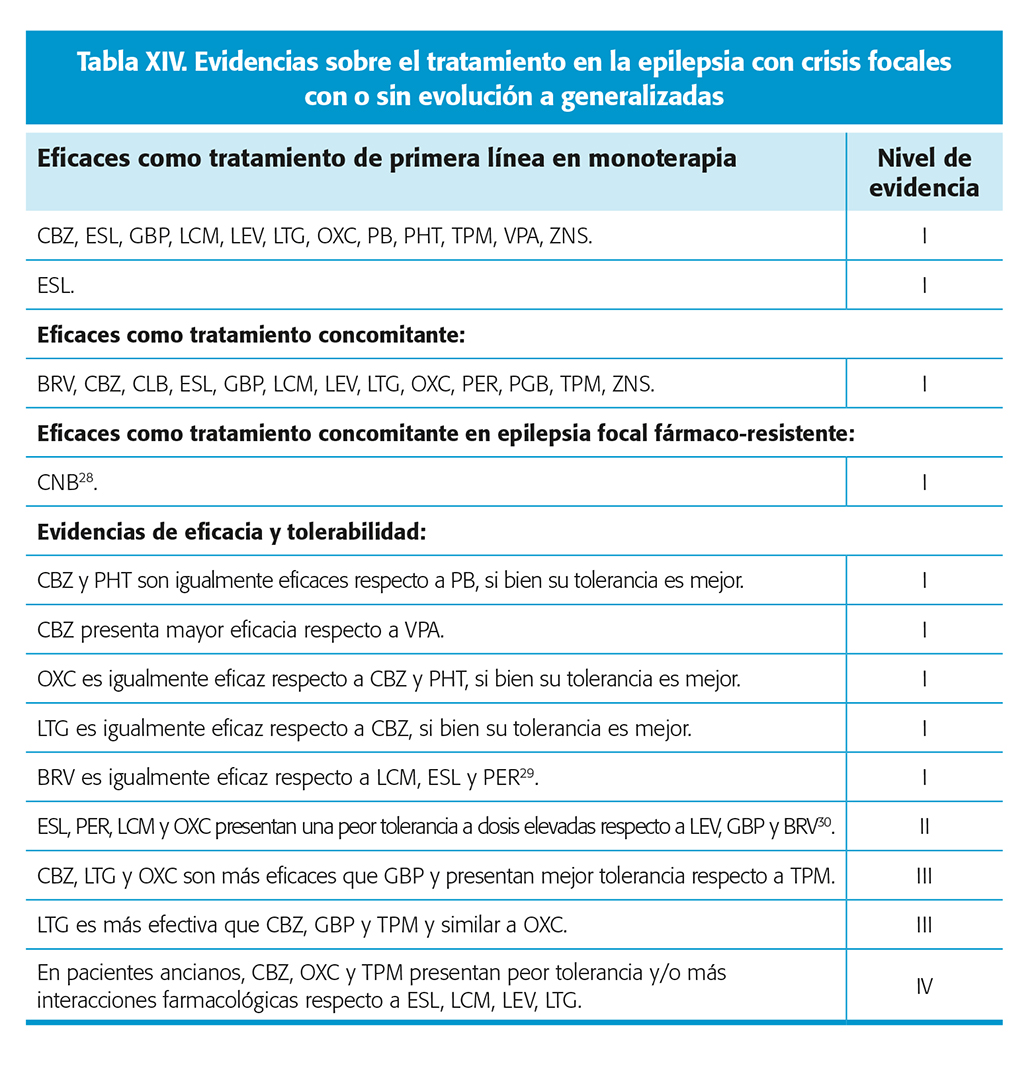
Evidencia sobre el tratamiento de la epilepsia con crisis focales (con o sin evolución a generalizadas) en adultos (tabla XIV)
Se revisaron los distintos niveles de evidencia científica de las siguientes sociedades científicas, así como la literatura disponible relativa a ensayos clínicos aleatorizados (ECA) o revisiones sistemáticas.
- ILAE, 20134.
- Sociedad Americana de Epilepsia (AES), 20188, 25.
- Sociedad Andaluza de Epilepsia. Guía Andaluza de Epilepsia, 20207.
- Standard and new antiepileptic drugs (SANAD): 2007. ECA no ciego comparando 8 FAC, 4 clásicos (CBZ, PB, PHT, VPA) y 4 de segunda generación (GBP, LTG, OXC,TPM)9,26.
- Consenso nacional sobre el inicio del tratamiento de la epilepsia (consenso Delphi 2019)27.
La mayoría de los ensayos clínicos ECA comparan la eficacia de los nuevos FAC con placebo o con un FAC clásico, siendo el más frecuentemente comparado CBZ seguido de PHT y VPA.
Hasta la fecha existen pocos ECA que comparen entre sí los nuevos FAC. Se han realizado algunos metaanálisis a partir de los ECA pivotales individuales de cada fármaco.
En los últimos años han obtenido la aprobación de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) como tratamiento concomitante en epilepsia con crisis focales (con o sin evolución a generalizadas) los siguientes FAC: PER (2012), ESL (2015), BRV (2017). Además, se añadió la indicación como monoterapia en primera línea en este tipo de epilepsia para ZNS (2012), LCM (2016) y ESL (2017). Por último, en marzo de 2021, la EMA aprobó el uso de CNB como tratamiento concomitante en epilepsia con crisis focales en adultos en los que no se ha conseguido control de crisis tras haber probado el tratamiento con al menos dos FAC.
En 2013 se restringió el uso de retigabina (que había sido aprobada en 2011 para el tratamiento adyuvante de la epilepsia con crisis focales con o sin generalización secundaria) tras la notificación de casos de pigmentación ocular y cutánea. Retigabina fue retirada del mercado en junio 2017.
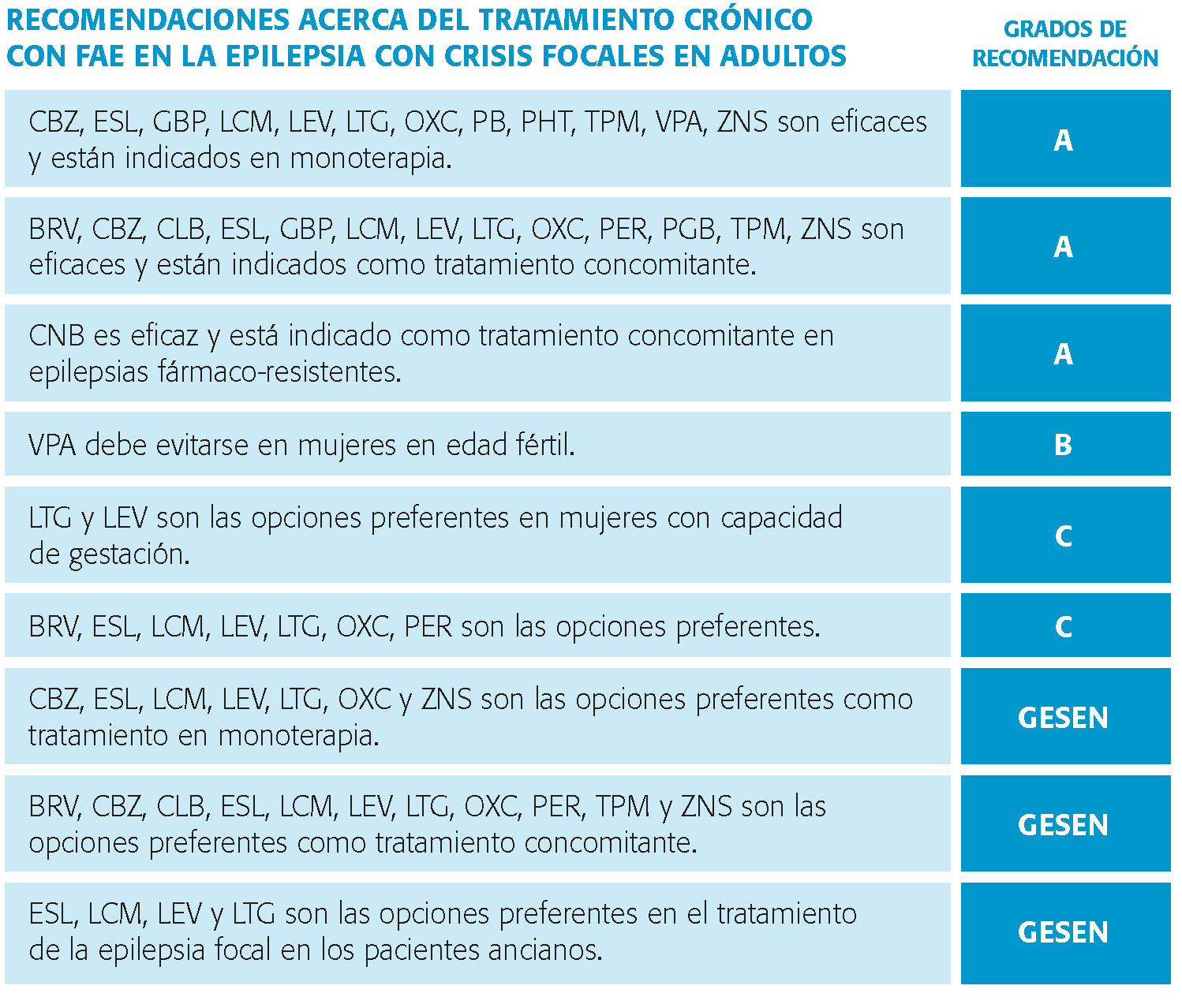
Recomendaciones acerca del tratamiento crónico con fármacos anticrisis en la epilepsia con crisis focales en adultos
Evidencia sobre el tratamiento de la epilepsia con crisis primariamente generalizadas en adultos (tabla XV)
Se revisaron los distintos niveles de evidencia científica de las siguientes sociedades científicas, así como la literatura disponible relativa a EC aleatorizados o revisiones sistemáticas.

- ILAE, 20134.
- Sociedad Americana de Epilepsia (AES), 20188,25.
- Sociedad Andaluza de Epilepsia. Guía Andaluza de Epilepsia, 20207.
- SANAD: Standard and new antiepileptic drugs. 2007. ECA no ciego comparando 8 FAC, 4 clásicos (CBZ, PB, PHT, VPA) y 4 de segunda generación (GBP, LTG, OXC,TPM)26, 9.
- Segundo consenso nacional sobre el inicio del tratamiento de la epilepsia (consenso Delphi 2019)27.
No se dispone en la actualidad de ECA de metodología óptima acerca del tratamiento de este tipo de epilepsia. Sin embargo, varios estudios en distintos FAC en crisis focales incluyeron subgrupos de pacientes con crisis de inicio generalizado, aunque probablemente existan sesgos en la clasificación de la epilepsia en estos pacientes.

Si bien CBZ, OXC y PHT han demostrado efectividad en el tratamiento de las crisis generalizadas tónico-clónicas, debe considerarse que pueden empeorar algunos tipos de crisis generalizadas y las crisis en determinados síndromes epilépticos. En mayo de 2015, PER obtuvo la aprobación de la AEMPS para el tratamiento concomitante de las crisis primariamente generalizadas tónico-clónicas en pacientes con epilepsia generalizada de edad igual o mayor a 12 años. Además, en octubre de 2020, LCM obtuvo la aprobación de la EMA para el tratamiento concomitante de la epilepsia con crisis generalizadas tónico-clónicas.
TRATAMIENTO ANTICRISIS EN PACIENTES CON ESCLEROSIS TUBEROSA
El complejo esclerosis tuberosa (CET) es una enfermedad de origen genético, multisistémica y de expresividad variable, que se caracteriza por el crecimiento de tumores benignos, llamados hamartomas. Las lesiones en el SNC aparecen en el 80-95 % de los casos: displasias corticales (túberes y líneas de migración radial), los nódulos subependimarios y los astrocitomas subependimarios de células gigantes (SEGA). La epilepsia es el síntoma más frecuente, apareciendo en el 75-90 % de los pacientes, siendo habitual que se inicie en la infancia.
El tratamiento de la epilepsia depende del tipo de crisis. En la infancia más precoz, si se presenta con un síndrome de West, el tratamiento de elección en este caso es la VGB37
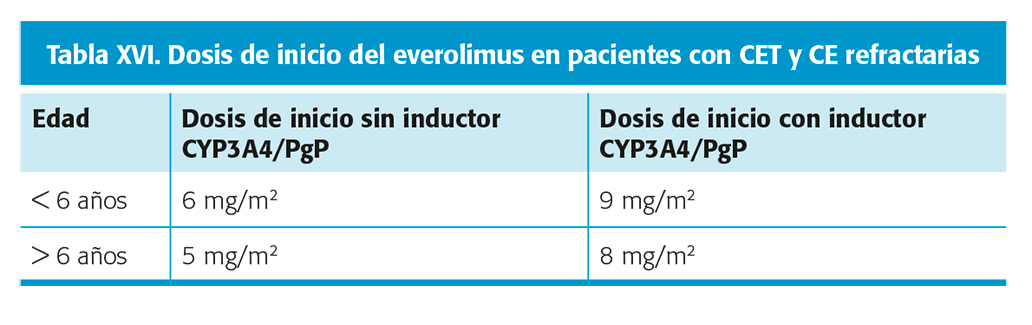
En un ECA se demostró la reducción del número de crisis epilépticas en estos pacientes con everolimus (un fármaco inhibidor de la vía mTOR, previamente aprobado por la EMA y la FDA para su uso en los SEGA asociados al CET)38. Nivel de evidencia I. Estaría indicado en las crisis epilépticas de inicio focal farmacorresistentes con o sin evolución a crisis bilaterales tónico-clónicas, asociadas al CET en pacientes mayores de 2 años. Las dosis de inicio recomendadas vienen recogidas en la tabla XVI. Las dosis se deben ajustar para alcanzar concentraciones valle de 5 a 15 ng/ml. Los efectos adversos más frecuentes son las úlceras bucales y/o estomatitis.
El CBD ha sido también aprobado para el tratamiento concomitante de las crisis asociadas a esta enfermedad en pacientes a partir de los 2 años de edad, atendiendo a los resultados de un ECA39.
Bibliografía
- Van Dijkman SC, Alvarez-Jimenez R, Danhof M, Della Pasqua O. Pharmacotherapy in pediatric epilepsy: from trial and error to rational drug and dose selection-a long way to Expert Opin Drug Metab Toxicol. 2016; 12: 1143-56.
- Santulli L, Coppola A, Balestrini S, Striano S. The challenges of treating epilepsy with 25 antiepileptic Pharmacol Res. 2016; 107: 211-9.
- Wilmshurst JM, Gaillard WD, Vinayan KP, Tsuchida TN, Plouin P, Van Bogaert P, et al. Summary of recommendations for the management of infantile seizures: Task Force Report for the ILAE Commission of Epilepsia. 2015; 56: 1185-97.
- Glauser T, Ben-Menachem E, Bourgeois B, Cnaan A, Guerreiro C, Kälviäinen R, et al. ILAE Subcommission on AED Guidelines. Updated ILAE evidence review of antiepileptic drug efficacy and effectiveness as initial monotherapy for epileptic seizures and Epilepsia. 2013; 54: 551-63.
- Rosati A, Ilvento L, Lucenteforte E, Pugi A, Crescioli G, McGreevy KS, et al. Comparative efficacy of antiepileptic drugs in children and adolescents: a network meta-analy- Epilepsia. 2018; 59: 297-314.
- National Institute for Health Care Clinical Excellence (NICE), guideline [CG137]. Epilepsies: diagnosis and management. Published date: January 2012. Last updated: April www.nice.org.uk
- Sociedad Andaluza de Epilepsia (SADE). Guía Andaluza de Epilepsia 2020: Diagnós- tico y tratamiento de la epilepsia en niños y adultos. http://sade.org.es/wp-content/uploads/2021/10/GUIA-SADE-2020.pdf
- Kanner AM, Ashman E, Gloss D, Harden C, Bourgeois B, Bautista JF, et Practice guideline update summary: Efficacy and tolerability of the new antiepileptic drugs I: Treatment of new-onset epilepsy: Report of the Guideline Development, Dissemination, and Implementation Subcommittee of the American Academy of Neurology and the American Epilepsy Society. Neurology. 2018; 91: 74-81.
- Marson AG, Appleton R, Baker GA, Chadwick DW, Doughty J, Eaton B, et A randomized controlled trial examining the longer-term outcomes of standard vs. new antiepileptic drugs. The SANAD trial. Health Technol Asses. 2007; 11: 1-134.
- Kanner AM, Ashman E, Gloss D, Harden C, Bourgeois B, Bautista JF, et Practice guideline update summary: efficacy and tolerability of the new antiepileptic drugs II: treatment-resistant epilepsy: Report of the Guideline Development, Dissemination, and Implementation Subcommittee of the American Academy of Neurology and the American Epilepsy Society. Neurology. 2018; 91: 82-90.
- Arzimanoglou A, D’Cruz O, Nordli D, Shinnar S, Holmes GL; Pediatric Epilepsy Academic Consortium for Extrapolation (PEACE). A review of the new antiepileptic drugs for focal-onset seizures in pediatrics: role of Paediatr Drugs. 2018; 20: 249-64.
- Striano P, Belcastro V. Update on pharmacotherapy of myoclonic seizures. Expert Opin 2017; 18: 187-93.
- Poleon S, Szaflarski JP. Photosensitivity in generalized epilepsies. Epilepsy Behav. 2017; 68: 225-33.
- Wirrell Treatment of Dravet Syndrome. Can J Neurol Sci. 2016; 43 (Suppl 3): S13-8.
- Devinsky O, Cross JH, Laux L, Marsh E, Miller I, Nabbout R, et Cannabidiol in Dravet Syndrome Study Group. Trial of cannabidiol for drug-resistant seizures in the Dravet Syndrome. N Engl J Med. 2017; 376: 2011-20.
- Song JM, Hahn J, Kim SH, Chang Efficacy of treatments for infantile spasms: a systematic review. Clin Neuropharmacol. 2017; 40: 63-84.
- O’Callaghan FJ, Edwards SW, Alber FD, Hancock E, Johnson AL, Kennedy CR, et Safety and effectiveness of hormonal treatment vs. hormonal treatment with vigabatrin for infantile spasms (ICISS): a randomised, multicentre, open-label trial. Lancet Neurol. 2017; 16: 33-42.
- Cross JH, Auvin S, Falip M, Striano P, Arzimanoglou A. Expert opinion on the management of Lennox-Gastaut Syndrome: treatment algorithms and practical considera Front Neurol. 2017; 8: 505.
- Asadi-Pooya AA. Lennox-Gastaut syndrome: a comprehensive review. Neurol Sci 2018; 39: 403-14.
- Devinsky O, Patel AD, Cross JH, Villanueva V, Wirrell EC, Privitera M, et GWPCARE3 Study Group. Effect of cannabidiol on drop seizures in the Lennox-Gastaut Syndrome. N Engl J Med. 2018; 378: 1888-97.
- Oguni H, Tanaka T, Hayashi K, Funatsuka M, Sakauchi M, Shirakawa S, et Treatment and long-term prognosis of myoclonic-astatic epilepsy of early childhood. Neuropediatrics. 2002; 33: 122-32.
- Veggiotti P, Pera MC, Teutonico F, Brazzo D, Balottin U, Tassinari CA. Therapy of encephalopathy with status epilepticus during sleep (ESES/CSWS syndrome): an upda Epileptic Disord. 2012; 14: 1-11.
- Kwan P, Brodie MJ. Drug treatment of epilepsy: when does it fail and how to optimize its use? CNS 2004; 9: 110-9.
- Agencia Española de Medicamentos y Productos Sanitarios. AEMPS: Valproato (©Depakine/©Depakine Crono): Programa de prevención de embarazos [Internet]. Publicado el 24 Jul 2018. Consultado el 21 Ago 2019. Disponible en: www.aemps.es
- Vossler DG, Weingarten M, Gidal BE; American Epilepsy Society Treatments Com Summary of Antiepileptic Drugs Available in the United States of America. Epilepsy Curr. 2018; 18: 1-26.
- Marson AG, Al-Kharusi AM, Alwaidh M, Appleton R, Baker GA, Chadwick DW, et SANAD Study Group. The SANAD study of effectiveness of carbamazepine, gabapentin, lamotrigine, oxcarbazepine or topiramate for treatment of partial epilepsy: an unblended randomized controlled trial. Lancet. 2007; 369: 1000-15.
- Carreño M, Gil-Nagel A, Salas J, Sánchez JC, Villanueva V. Segundo consenso nacional sobre el inicio del tratamiento de la Resultados y conclusiones. Primera edición. Madrid: Editorial UFV; 2019.
- Brigo F, Bragazzi NL, Nardone R, Trinka E. Efficacy and tolerability of brivaracetam compared to lacosamide, eslicarbazepine acetate, and perampanel as adjunctive treatments in uncontrolled focal epilepsy: results of an indirect comparison meta-analysis of Seizure. 2016; 42: 29-37.
- Zaccara G, Giovannelli F, Giorfi FS. Tolerability of new antiepileptic drugs: a network meta-analysis. Eur J Clin Pharmacol. 2017; 73: 811-7.
- Lattanzi S, Trinka E, Zaccara G, Striano P, Russo E, Del Giovane C, et al. Third-generation antiseizure medications for adjunctive treatment of focal-onset seizures in adults: A systematic review and network meta-analysis. Drugs. 2022; 82(2): 199-218.
- 31.Zhang H, Ou Z, Zhang E, Liu W, Hao N, Chen Y, et al. Efficacy and safety of add-on anti-seizure medications for focal epilepsy: A network meta-analysis. Epilepsia Open. 2024; 9(4): 1550-64.
- Coppola G, Piccorossi A, Operto FF, et Anticonvulsant drugs for generalized tonic-clonic epilepsy. Expert Opin Pharmacother 2017; 18: 925-936.
- French JA, Krauss GL, Wechsler RT, Verrotti Perampanel for tonic-clonic seizures in idiopathic generalized epilepsy. A randomized trial. Neurology. 2015; 85: 950-7.
- Vossler DG, Knake S, O’Brien TJ, Watanabe M, Brock M, Steiniger-Brach B, et al. Efficacy and safety of adjunctive lacosamide in the treatment of primary generalised tonic-clonic seizures: a double-blind, randomised, placebo-controlled trial. J Neurol Neurosurg Psychiatry. 2020 Oct; 91(10): 1067-75.
- Kwan P, Trinka W, Van Paesschen W, Rektor I, Johnson ME, Lu S. Adjunctive brivaracetam for uncontrolled focal and generalized epilepsies: results of a phase III, double-blind, randomized, placebo-controlled, flexible-dose Epilepsia. 2014; 55: 38-46.
- Strzelczyk A, Kay L, Bauser S, Immisch I, Klein KM, Knake S, et Use of brivaracetam in genetic generalized epilepsies and for acute, intravenous treatment of absence status epilepticus. Epilepsia. 2018; 59: 1549-56.
- De Saint Martin A, Napuri S, Nguyen S. Tuberous sclerosis complex and epilepsy in infancy: prevention and early diagnosis. Arch Pediatr. 2022 Dec;29(5S):5S8-5S13.
- French JA, Lawson JA, Yapici Z, Ikeda H, Polster T, Nabbout R, et al. Adjunctive everolimus therapy for treatment-resistant focal-onset seizures associated with tuberous sclerosis (EXIST-3): a phase 3, randomized, double-blind, placebo-controlled study. 2016; 388: 2153-63.
- Thiele EA, Bebin EM, Bhathal H, Jansen FE, Kotulska K, Lawson JA, et al; GWPCARE6 Study Group. Add-on cannabidiol treatment for drug-resistant seizures in tuberous scle-rosis complex: a placebo-controlled randomized clinical trial. JAMA Neurol. 2021; 78(3): 285-92.

