INTRODUCCIÓN
El factor más importante de los buenos resultados en la cirugía de la epilepsia es la elección de los candidatos. Por ese motivo es crucial determinar el foco epileptogénico y su etiología. Los estudios de neuroimagen son cruciales en la evaluación de esos pacientes.
Los estudios de neuroimagen proporcionan información de las anomalías estructurales, que probablemente sean el foco epileptogénico y también de la posible etiología subyacente de las crisis y de las anomalías funcionales (metabolismo, alteración del flujo cerebral, etc.) que pueden señalar el foco epileptogénico.
Las ventajas de los estudios de neuroimagen respecto a otras técnicas de diagnóstico son principalmente, que primero, son técnicas no invasivas, segundo pueden influenciar en el pronóstico de la cirugía, en tanto en que pueden influenciar en la selección de pacientes y en el procedimiento quirúrgico; y por último y más importante, los pacientes pueden tener más información de los riesgos y beneficios de la cirugía.
Debe considerarse la posibilidad de que exista una lesión estructural en la mayoría de los enfermos con epilepsia, excepto cuando los datos de la historia clínica, la exploración y el EEG apoyan de forma inequívoca el diagnóstico de epilepsia generalizada idiopática o focal benigna de la infancia44. Cerca del 90 % de los adultos que desarrollan epilepsia presentan una lesión focal, especialmente si las crisis son focales. Las lesiones más frecuentemente encontradas son la Esclerosis Temporal Medial (ETM), Malformaciones con alteración del desarrollo cortical (MDC), tumores y lesiones vasculares o postraumáticas.
Las guías de neuroimagen propuestas por la Liga Internacional Contra la Epilepsia (ILAE) en 1997 recomiendan que se realice una resonancia magnética (RM) cerebral con protocolo de epilepsia de forma programada en todo paciente con diagnóstico reciente de epilepsia.45 Diferentes estudios muestran que el porcentaje de alteraciones que se encuentran cuando se realiza una RM cerebral adecuada para el estudio de epilepsia aumenta significativamente (del 49 al 71 % %) y además este porcentaje es aún mayor si la interpretación de la imagen la realiza un experto en epilepsia; se han llegado a encontrar lesiones hasta en el 85 % de los estudios previamente considerados normales46-48
. Nivel de evidencia III.
Los imanes de 3T detectan más lesiones en pacientes epilépticos (hasta el 40 % en caso de RM de 1.5T negativa) especialmente en el estudio de displasias corticales focales (DCF)49, pero hace falta más experiencia para definir su papel como alternativa a los imanes de 1.5T. Nivel de evidencia IV.
Aunque la información obtenida con la RM estructural es esencial para la evaluación de pacientes con EFR, en aquellos casos en que no se detecten anomalías estructurales, sean dudosos o discordantes con otras pruebas clínicas, los estudios funcionales pueden contribuir a localizar el foco epileptogénico y por lo tanto también tienen un papel importante en la evaluación prequirúrgica de los pacientes con EFR.
Este apartado consta de dos partes bien diferenciadas. La primera parte está dedicada a los estudios de neuroimagen estructural, detallando los diferentes protocolos en relación al tipo de crisis y edad de aparición. En el segundo apartado se describen los procedimientos de neuroimagen funcional. En cada técnica se discutirán las indicaciones, estándares de procedimiento y recomendaciones.
En la literatura no hay estudios de neuroimagen aleatorizados que permitan tener información basada en la evidencia para estudios diagnósticos con niveles I ni II. Los estudios que existen en la literatura comparan únicamente técnicas de neuroimagen con otras técnicas que se consideran de referencia, que no son patrón oro y que básicamente son los estudios de EEG, combinaciones de varios test o la cirugía. Por lo tanto, las recomendaciones se basarán en niveles III y IV.
NEUROIMAGEN ESTRUCTURAL
Indicaciones de estudios de Neuroimagen estructural
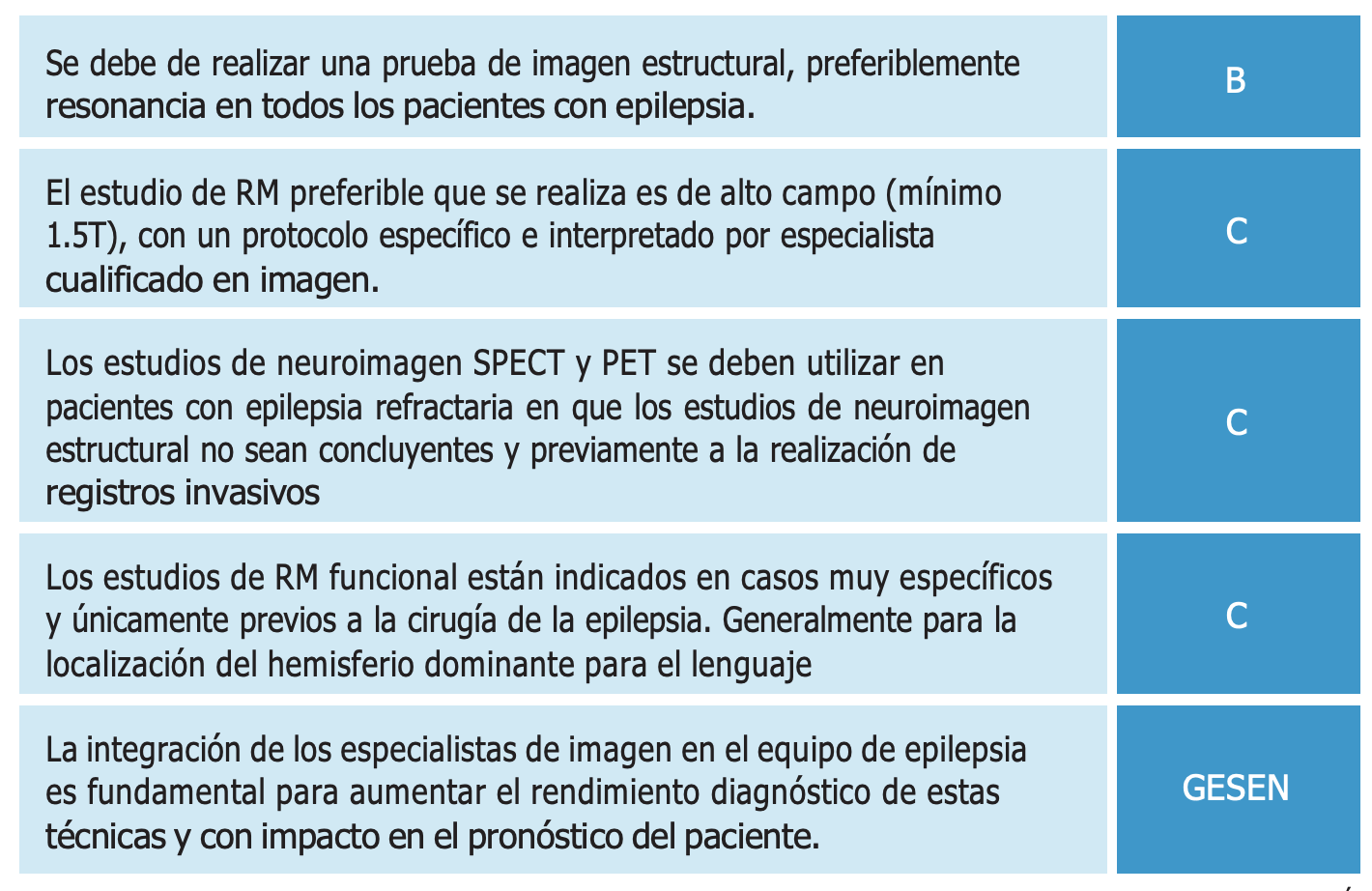
La indicación de pruebas de imagen en epilepsia ha variado con los adelantos en las técnicas y ha de adaptarse según el contexto clínico. La semiología de las crisis, el patrón de EEG y el momento de aparición, así como si se trata de pacientes con crisis de inicio o pacientes con epilepsia conocida van a determinar la mejor combinación de pruebas de imagen. En el año 2008, la Academia Americana de Radiología (ACR) publicó unas recomendaciones basadas en el grado de evidencia en la que se indica la utilidad de las distintas pruebas diagnósticas (tabla XXII). Estas recomendaciones han sido actualizadas en el año 201150 y adaptadas a los distintos contextos clínicos.
La ILAE recomienda en general realizar una RM con protocolo de epilepsia a todo paciente epiléptico, con la excepción de la Epilepsia Generalizada Idiopática45, pero, además, debe realizarse una RM ante cualquier cambio en el patrón de las crisis o en la exploración neurológica o neuropsicológica (tabla XXIII), con un grado de recomendación B. También ha publicado recomendaciones en las que puede ser útil realizar TC, especialmente en pacientes con crisis de inicio en situación de urgencia (tabla XXIV).
A continuación, se describen situaciones más específicas.
Evaluación de crisis de inicio en adultos
La aparición de crisis puede ser la primera manifestación de una epilepsia o puede tratarse de un síntoma de una enfermedad sistémica, tumor, infección o síndrome que ne-
 cesitan un diagnóstico y tratamiento inmediatos. Por otro lado, es frecuente que después de una historia clínica cuidadosa realizada por un especialista, pacientes con diagnóstico en la urgencia de crisis de inicio realmente tengan antecedentes que los identifican como pacientes epilépticos y por tanto requieran una RM con protocolo de epilepsia.
cesitan un diagnóstico y tratamiento inmediatos. Por otro lado, es frecuente que después de una historia clínica cuidadosa realizada por un especialista, pacientes con diagnóstico en la urgencia de crisis de inicio realmente tengan antecedentes que los identifican como pacientes epilépticos y por tanto requieran una RM con protocolo de epilepsia.
El principal objetivo de las pruebas de imagen en un paciente con una primera crisis es descartar cualquier causa que requiera un tratamiento inmediato. La TC, por su disponibilidad y suficiente sensibilidad para detectar sangrado agudo, tumores o colecciones líquidas es la prueba de elección en la mayoría de los casos que se presentan dentro de un cuadro agudo. La AAN recomienda, con un nivel B la realización de una prueba de imagen a todo paciente adulto con crisis de inicio, pero no recomienda específicamente si debe ser TC o RM51 (tablas XXV y XXVI). Más recientemente, la ACR ha publicado recomendaciones más concretas en pacientes con crisis de inicio, dependiendo de la edad, la existencia de déficit neurológico o si existe un evento traumático relacionado actual o previo50. Aunque la RM es en general la prueba más recomendada por la AAN, en el paciente urgente o con sintomatología aguda se reconoce que la TC puede ser la técnica de elección51.
En pacientes con epilepsia ya diagnosticada y con pruebas de imagen previas, puede estar indicada la realización de una RM. Esta nueva RM está indicada si la RM previa 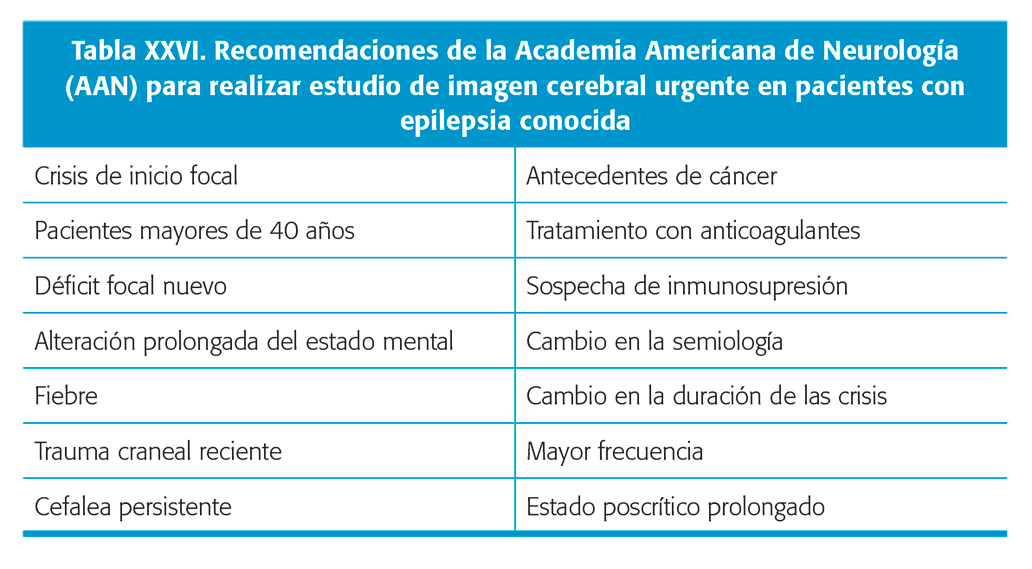 es muy antigua, no está realizada con el protocolo adecuado, o especialmente si la anterior es dudosa o negativa. También está recomendado repetir el estudio de RM cuando la semiología o la clínica varíe52.
es muy antigua, no está realizada con el protocolo adecuado, o especialmente si la anterior es dudosa o negativa. También está recomendado repetir el estudio de RM cuando la semiología o la clínica varíe52.
Evaluación de crisis de inicio en niños
La incidencia de crisis neonatales es de alrededor del 0,3 %/año y la causa más frecuente es con mucho la encefalopatía hipóxico-isquémica (EHI) y el 90 % de los casos las crisis se presentan en los 3 primeros días, por lo que a partir de la primera semana hay que pensar antes en una infección o una MDC. Aunque inicialmente siempre se practica una ecografía, la RM ha cobrado gran valor, especialmente en casos dudosos o para definir mejor la extensión de la lesión. Se recomienda realizar siempre una secuencia de difusión, ya que es más sensible que las secuencias T1 y T2 (en el periodo neonatal las secuencias FLAIR son de escaso valor ya que debido a la falta de mielinización tienen escaso contraste) y puede definir mejor la extensión de una lesión isquémica aguda53. Nivel de evidencia IV. En niños con crisis febriles simples no está indicada la realización de una prueba de imagen, que se reserva para aquellos con crisis febriles complejas, cuando hay alteración posterior del nivel de conciencia o existe déficit neurológico focal y cuando se sospecha antecedente traumático54. En los niños con crisis de comienzo no febriles es importante establecer si se trata de crisis generalizadas o focales, ya que la mayoría de los casos con crisis generalizadas que no asocian otras alteraciones presentan RM negativa. Sin embargo, cuando existe alteración neurológica debe indicarse una RM ya que puede tratarse de una crisis focal con generalización rápida y además la mayoría de estos pacientes presentará crisis recurrentes.
Cuando se trata de crisis focales, más del 50 % de los casos presentarán alteraciones en la prueba de imagen siendo la RM mucho más sensible que la TC para la detección de la causa. Más del 90 % de los pacientes con crisis focales de inicio recurrirán. Aunque la TC es más accesible en la urgencia, es preferible realizar una RM de forma pautada a una TC urgente, a menos que la clínica obligue a descartar una lesión aguda o un proceso expansivo, o en el caso de que exista sospecha de maltrato54. Si existe un antecedente traumático, la TC identifica el 100 % de las lesiones que requieren tratamiento inmediato y la RM está raramente indicada, aunque puede servir para detectar restos hemáticos o gliosis postraumática. En pacientes menores de 2 años con crisis afebriles hay que considerar la posibilidad de maltrato incluso en ausencia de signos de trauma, lo cual indicaría la realización de una TC.
Algunos de los pacientes pediátricos con crisis de inicio pueden presentar un síndrome electroclínico característico que no necesita confirmación mediante imagen. Es el caso de las ausencias con EEG característico, la epilepsia rolándica u occipital benigna y las crisis mioclónicas juveniles. en el síndrome de West ha de hacerse una RM dada la alta frecuencia de displasias corticales focales (tabla XXVII).

Evaluación del estatus epiléptico
El status epilepticus (SE) representa un riesgo vital y requiere diagnóstico y tratamiento inmediato; los estudios de imagen estarán recomendados dependiendo del contexto clínico. Cuando existe un déficit focal o cuando el estado de conciencia no se recupera en las siguientes horas debe hacerse una prueba de imagen urgente55. No hay recomendaciones específicas para la realización de RM o TC, pero hay que tener en cuenta que la RM es más sensible y que las secuencias de difusión pueden mostrar alteraciones perictales que ayudan a localizar el posible origen y a detectar complicaciones, por lo que debe indicarse una RM si es accesible en la urgencia que debe realizarse una vez estabilizado el paciente. No hay suficiente evidencia para recomendar un estudio de imagen de forma rutinaria. En caso de existir crisis focales, debe aplicarse el mismo criterio que en pacientes con crisis de inicio, por lo que se recomienda una RM reglada.
Evaluación de las crisis refractarias
Alrededor del 30 % de los pacientes con crisis focales presentan criterios de refractariedad y muchos de esos casos son candidatos quirúrgicos, ya que cuando la cirugía es factible y se identifica una lesión en RM congruente con los datos electroclínicos hasta el 70 % de los pacientes pueden quedar libres de crisis. El estudio de estos pacientes ha de llevarse a cabo en Unidades de Epilepsia con tecnología y personal especializado. No es posible, con los niveles de evidencia actuales, determinar cuál es el protocolo más adecuado ya que cada caso debe evaluarse de forma personalizada y con un enfoque multidisciplinar, pero en general la RM estructural tiene un papel determinante56 por lo que debe revisarse en primer lugar la calidad de los estudios previos del paciente para determinar si debe repetirse la RM con un protocolo más adecuado (grado de recomendación SEN). Si la RM estructural es dudosa o negativa será necesario realizar estudios funcionales. El papel de la RM de 3T en estos casos es cada vez más claro, tanto por las publicaciones recientes como por la experiencia clínica, que indican que puede obtenerse información adicional relevante en muchos casos, por lo que debe valorarse siempre la realización de esta prueba57. El protocolo de una RM de 3T no varía mucho respecto al de 1.5T, pero la señal y el contraste son mejores debido al aumento del campo magnético. El aumento de señal permite mejorar la resolución espacial tanto en los estudios 2D como 3D (tabla XXVIII) y se aplica de forma rutinaria la secuencia 3D-FLAIR.
Estándares clínicos para la realización de la RM estructural
El campo magnético mínimo recomendable del escáner de RM debe de ser de 1.5T aunque como se ha mencionado previamente los escáneres de 3T proporcionan mayor resolución y probablemente sean capaces de detectar lesiones más pequeñas.
No hay estudios con nivel de certeza I-II acerca de las secuencias específicas de RM que se deben emplear en un protocolo específico para epilepsia. Sin embargo, sí que existe información abundante y nivel de certeza II que indica que un protocolo específico para epilepsia aporta información relevante que se escapa en un estudio de rutina46,47. La mayoría de los autores recomiendan un protocolo similar al que denominamos “básico”. (tabla XXVII). La disponibilidad de la secuencia 3D-FLAIR es ya habitual, por lo que se recomienda aplicarla de forma rutinaria, aunque con tiempo de exploración suficiente para conservar una señal adecuada. En caso de no estar disponible o de dificultades de colaboración puede sustituirse por secuencias 2D.
También es importante una correcta interpretación de los hallazgos observados en los estudios de neuroimagen estructural48. La rentabilidad diagnóstica de la técnica aumenta con el empleo de técnicas de mayor resolución {Knake, 2005 3 /id}, pero también aumenta significativamente cuando la lectura es realizada por neurorradiólogos expertos en el manejo del paciente epiléptico46-48. Es importante la integración de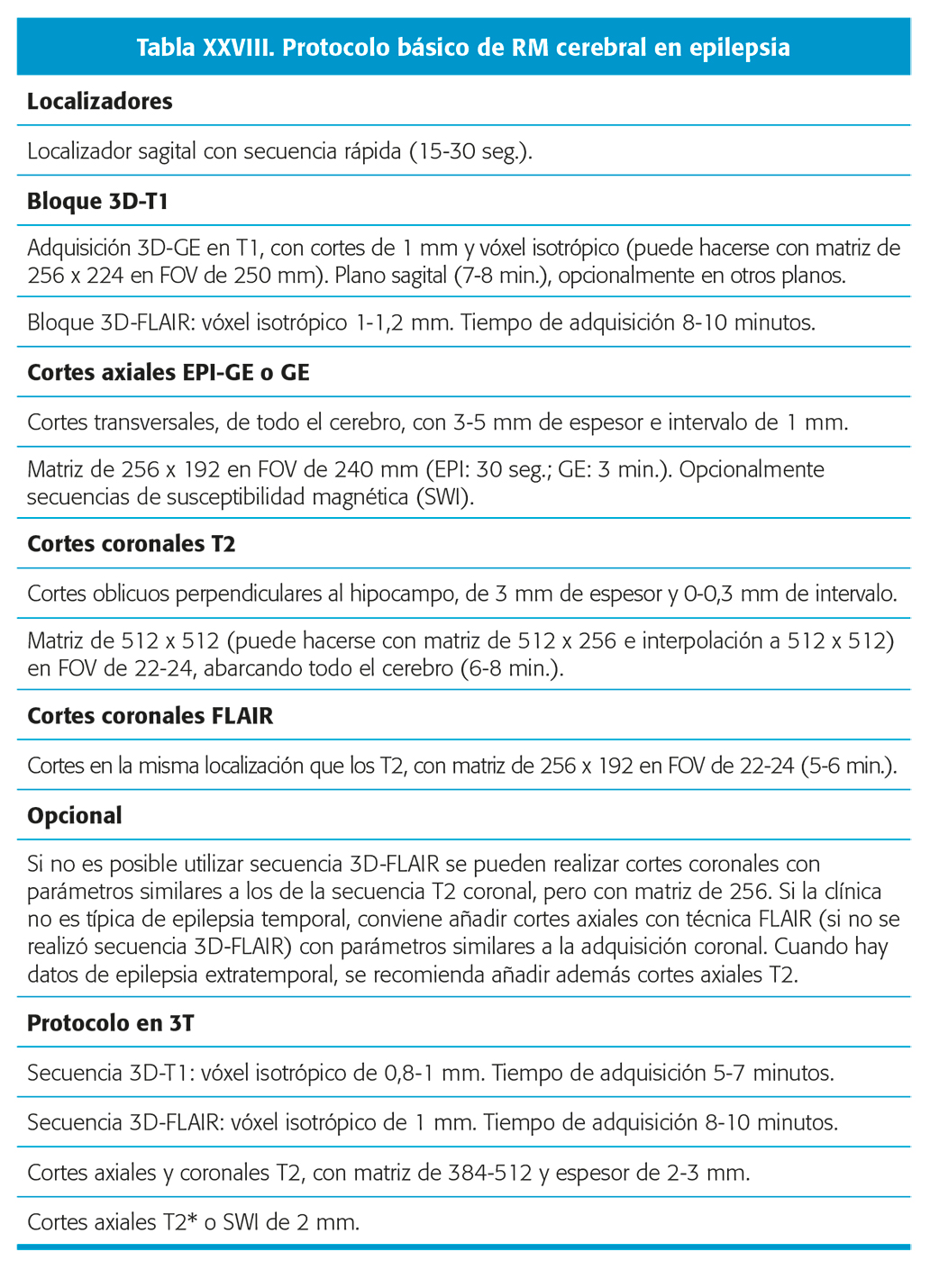 los especialistas en imagen tanto de medicina nuclear como de Neurorradiología en las Unidades funcionales de Epilepsia ya que la revisión conjunta de todas las pruebas diagnósticas aumenta las posibilidades diagnósticas y por lo tanto terapéuticas.
los especialistas en imagen tanto de medicina nuclear como de Neurorradiología en las Unidades funcionales de Epilepsia ya que la revisión conjunta de todas las pruebas diagnósticas aumenta las posibilidades diagnósticas y por lo tanto terapéuticas.
NEUROIMAGEN FUNCIONAL
Lo estudios de neuroimagen funcional que se van a comentar en este estudio se dividen en dos grandes grupos. El primer grupo es el formado por técnicas de Medicina Nuclear que son la PET y SPECT. El SISCOM consiste en la substracción de la SPECT ictal e interictal y registro de la sustracción con la imagen estructural de RM. El otro grupo consiste en técnicas adquiridas con la RM y que son la RM funcional.
En la literatura no hay estudios de neuroimagen aleatorizados que permitirán tener información basada en la evidencia con niveles I, ni II. Los estudios que existen en la literatura comparan únicamente técnicas de neuroimagen con otras técnicas que se consideran de referencia, que no son patrón oro, y que básicamente son los estudios de EEG, combinaciones de varios test o la cirugía.
Estudios de resonancia magnética funcional (RMF)
Indicaciones
En la actualidad, aunque no exista una evidencia científica concluyente, se considera que la RM funcional es de utilidad y está indicada en algunos casos en que es necesario realizar una intervención quirúrgica58. Así pues, delante de una resección tumoral la RM funcional nos ayudara a reconocer si existen áreas primarias involucradas y si existe un riesgo de secuelas posquirúrgicas. En una revisión de la utilidad de los estudios de neuroimagen funcional en la planificación quirúrgica concurren que, en los pacientes candidatos a cirugía de la epilepsia, los estudios de RM funcional fueron determinantes para la viabilidad de la resección quirúrgica en un 70 % de los pacientes, ayudaron a la planificación quirúrgica en 43 % de los casos y en un 52 % fueron decisivos para seleccionar que pacientes requerían estudio de mapeo funcional invasivo durante la cirugía59. Nivel de evidencia III.
Aunque no existen niveles de evidencia suficientes para aceptar esta técnica en la práctica clínica, existen varios estudios que demuestran que los estudios de RMf para la la teralización del lenguaje pueden sustituir al test de Wada60-62. Sin embargo, solo existen pocos estudios que comparan la RMf con el mapping cortical intraoperativo sin obtener datos concluyentes en cuanto a la localización exacta de las áreas elocuentes del lenguaje. Sin embargo y aunque se han hechos varios estudios de RMf de memoria para determinar el potencial riesgo de caída de memoria tras la cirugía del lóbulo temporal, no existe evidencia científica que apoye el uso de esta técnica en la práctica clínica.
La RMf también ha sido utilizada para estudiar los cambios de señal de RM que se suceden durante la generación de la crisis epiléptica en un número reducido de estudios, por lo que por ahora no está clara su utilidad clínica.
Estándares clínicos para la realización de la RMF
Para realizar los estudios de RMf es necesario un scan de alto campo (mínimo 1.5T). La secuencia que se utiliza más comúnmente es la EPI-BOLD, aunque también se puede realizar con la técnica de ASL, sin embargo, ésta tiene menor resolución espacial.
Los puntos principales que se deben considerar para la buena realización de una RMf del lenguaje son la cooperación de los pacientes en tanto que deben colaborar en la ejecución de los paradigmas y en limitar el movimiento de la cabeza durante el examen y en la planificación y diseño de los paradigmas a utilizar. Por este motivo es esencial la colaboración multidisciplinar entre el neurólogo, el neurorradiólogo y el neuropsicólogo. Es recomendable utilizar paradigmas especiales para niños o personas con problemas cognitivos.
En los casos en que no se consiga una suficiente información para poder lateralizar el lenguaje, o los resultados obtenidos son discordantes con otras técnicas diagnósticas utilizadas para valorar el hemisferio dominante del lenguaje, como es la valoración neuropsicológica, se deberá proceder a realizar el test de Wada.
Otro punto crucial de los estudios de RMf es su interpretación. Las áreas de activación cerebral se obtienen mediante un análisis estadístico que demuestra cambios entre la fase de la realización de la tarea con una fase de control. Los métodos analíticos utilizados pueden variar según el método utilizado. Es muy importante estar familiarizado con los procesos de imagen. Los mapas de actuación obtenidas son dependientes de un umbral estadístico. No existe un umbral estandarizado y puede variar con la edad o con las patologías. Por esto es muy importante que la interpretación de los resultados obtenidos sea realizada por neurorradiólogos con experiencia en está técnica.
Recomendaciones
En el momento actual, no existe suficiente evidencia para concluir que la RMf pueda ser utilizada para el mapeo cortical funcional o para la localización del foco epileptogénico. Sin embargo, puede aportar suficiente información sobre la lateralización del lenguaje siempre que se apoye con otros test diagnósticos.
Tomografía por emisión de fotón simple (SPECT) y SISCOM
La SPECT detecta el flujo sanguíneo cerebral a través de agentes específicos y está indicada para apoyar la localización del foco epileptogénico, cuando se realiza en el periodo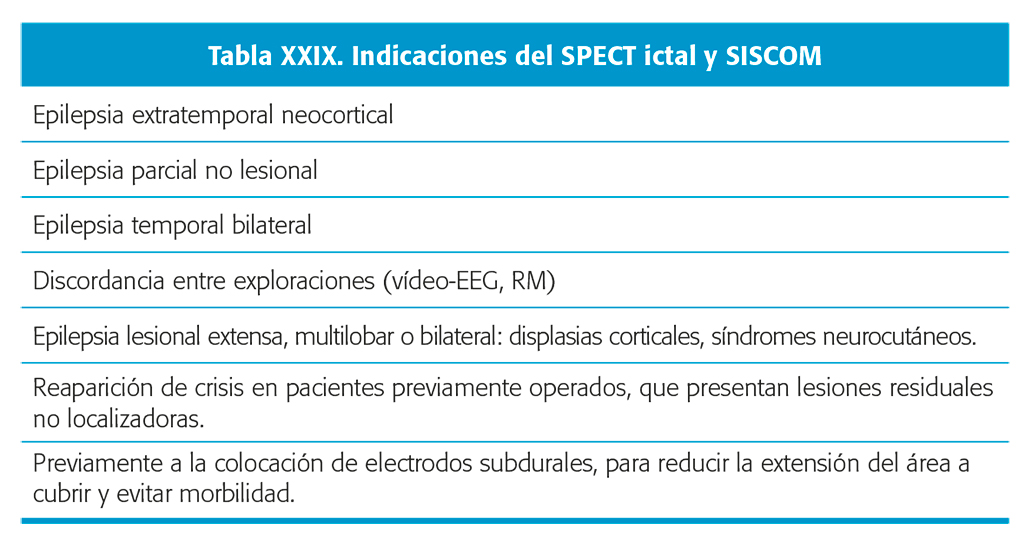 ictal o postictal y se compara con la SPECT interictal. En la SPECT ictal la inyección del trazador se lleva a cabo durante la crisis epiléptica y las imágenes gammagráficas pueden adquirirse hasta 2 horas después, una vez solucionada la CE. Se aconseja utilizar sistemas de inyección automática especialmente diseñados para administrar la dosis de la SPECT63. La información obtenida se incluye dentro de la valoración prequirúrgica, siendo especialmente útil en pacientes con RM normal, con lesiones no localizadoras de la epilepsia o cuando hay discrepancias entre el MVEEG y la RM (tabla XXIX).
ictal o postictal y se compara con la SPECT interictal. En la SPECT ictal la inyección del trazador se lleva a cabo durante la crisis epiléptica y las imágenes gammagráficas pueden adquirirse hasta 2 horas después, una vez solucionada la CE. Se aconseja utilizar sistemas de inyección automática especialmente diseñados para administrar la dosis de la SPECT63. La información obtenida se incluye dentro de la valoración prequirúrgica, siendo especialmente útil en pacientes con RM normal, con lesiones no localizadoras de la epilepsia o cuando hay discrepancias entre el MVEEG y la RM (tabla XXIX).
La capacidad para localizar la región epileptogénica de la SPECT ictal es superior al 90 % en pacientes con crisis del lóbulo temporal64 y su rentabilidad diagnóstica desciende en las crisis extratemporales. Nivel de evidencia IV.
El ictal SPECT co-registered to mri (SISCOM) consiste en el corregistro entre la imagen estructural de RM y la imagen de sustracción entre la SPECT interictal y el ictal (con sólo los cambios positivos de perfusión a favor de la SPECT ictal). La adquisición de la SPECT no varía del protocolo habitual, mientras que la RM debe ser de alta resolución con una adquisición 3D gradiente eco potenciada en T1, con grosor de corte inferior a 2 mm.
El SISCOM aporta resolución anatómica a la imagen de la SPECT, además de aumentar la sensibilidad y la especificidad de la SPECT y de la RM65. Nivel de evidencia IV.
Tomografía por emisión de positrones, PET
La PET con desoxiglucosa marcada con flúor 18 (18F-FDG) permite únicamente el estudio interictal del paciente, demostrando una hipocaptación por una disfunción cerebral en la región epileptógena. Su sensibilidad diagnóstica en la epilepsia del lóbulo temporal es del 86 % y del 67 % en la extratemporal66. Este rendimiento diagnóstico puede mejorarse con métodos de cuantificación que emplean programas estadísticos para comparar la imagen PET del paciente con una base de datos de PET normales67.
La PET interictal con 18F-FDG y la SPECT ictal tienen una capacidad diagnóstica similar en la epilepsia del lóbulo temporal. Como la PET no requiere de ingreso hospitalario, MVEEG, ni retirada de la medicación, como ocurre en la SPECT ictal, la PET es la exploración de imagen funcional más aconsejable en la epilepsia del lóbulo temporal.
En la epilepsia extratemporal, especialmente en la no lesional, la rentabilidad diagnóstica de la PET es inferior a la de la SPECT ictal, por lo que la SPECT parece la exploración funcional más aconsejable. sin embargo, la realización de ambas técnicas en la epilepsia extratemporal no lesional es recomendable ya que juntas pueden apoyar y redefinir el área de colocación de electrodos (tabla XXX). La PET es además muy útil para delimitar los márgenes de la lesión epileptógena antes de la cirugía68.
La interpretación de los resultados debe realizarse en centros cualificados. Es recomendable la colaboración de todos los especialistas de imagen y es muy valioso reinterpretar los estudios de RM posterior a la realización de la PET corregistrado con RM69. (Evidencia grado II).

 |
|
|
Bibliografía
- Von OJ, Urbach H, Jungbluth S, Kurthen M, Reuber M, Fernandez G, et al. Standard magnetic resonance imaging is inadequate for patients with refractory focal epilepsy. J Neurol Neurosurg 2002; 73: 643-7.
- McBride MC, Bronstein KS, Bennett B, Erba G, Pilcher W, Berg MJ. Failure of standard magnetic resonance imaging in patients with refractory temporal lobe epilepsy. Arch 1998; 55: 346-8.
- Duncan JS. Neuroimaging for epilepsy: quality and not just quantity is important. J Neurol Neurosurg 2002; 73: 612-3.
- Knake S, Triantafyllou C, Wald LL, Wiggins G, Kirk P, Larsson PG, et 3T phased array MRI improves the presurgical evaluation in focal epilepsies: a prospective study. Neurology. 2005; 65: 1026-31.
- American College of Radiology. ACR Appropriateness Criteria®: Seizures and Epi 2012; Disponible en https.acsearch.acr.org
- Krumholz A, Wiebe S, Gronseth G, Shinnar S, Levisohn P, Ting T, et al. Practice Parameter: evaluating an apparent unprovoked first seizure in adults (an evidence-based review): report of the Quality Standards Subcommittee of the American Academy of Neurology and the American Epilepsy Neurology. 2007; 69: 1996-2007.
- Harden CL, Huff JS, Schwartz TH, Dubinsky RM, Zimmerman RD, Weinstein S, et Reassessment: neuroimaging in the emergency patient presenting with seizure (an evidence-based review): report of the Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology. Neurology. 2007; 69: 1772-80.
- Krishnamoorthy KS, Soman TB, Takeoka M, Schaefer Diffusion-weighted imaging in neonatal cerebral infarction: clinical utility and follow-up. J Child Neurol. 2000; 15: 592-602.
- Hirtz D, Ashwal S, Berg A, Bettis D, Camfield C, Camfield P, et al. Practice parameter: evaluating a first nonfebrile seizure in children: report of the quality standards subcommittee of the American Academy of Neurology, The Child Neurology Society, and The American Epilepsy Neurology. 2000; 55: 616-23.
- Riviello JJ Jr., Ashwal S, Hirtz D, Glauser T, Ballaban-Gil K, Kelley K, et al. Practice parameter: diagnostic assessment of the child with status epilepticus (an evidence-based review): report of the Quality Standards Subcommittee of the American Academy of Neurology and the Practice Committee of the Child Neurology Neurology. 2006; 67: 1542-50.
- Guidelines for neuroimaging evaluation of patients with uncontrolled epilepsy considered for surgery. Commission on Neuroimaging of the International League Against Epilepsia. 1998; 39: 1375-6.
- Urbach H, Mast H, Egger K, Mader Presurgical MR Imaging in Epilepsy. Clin Neuroradiol. 2015; 25(Suppl 2)::151-5.
- Bargallo Functional magnetic resonance: new applications in epilepsy. Eur J Radiol. 2008; 67: 401-8.
- Lee CC, Ward HA, Sharbrough FW, Meyer FB, Marsh WR, Raffel C, et Assessment of functional MR imaging in neurosurgical planning. AJNR Am J Neuroradiol. 1999; 20: 1511-1519.
- Benke T, Koylu B, Visani P, Karner E, Brenneis C, Bartha L, et Language lateralization in temporal lobe epilepsy: a comparison between fMRI and the Wada test. Epilepsia. 2006; 47: 1308-19.
- Binder JR, Swanson SJ, Hammeke TA, Morris GL, Mueller WM, Fischer M, et al. Determination of language dominance using functional MRI: a comparison with the Wada Neurology. 1996; 46: 978-84.
- Desmond JE, Sum JM, Wagner AD, Demb JB, Shear PK, Glover GH, et Functional MRI measurement of language lateralization in Wada-tested patients. Brain. 1995; 118(Pt 6): 1411-9.
- Setoain X, Pavia J, Seres E, Garcia R, Carreño MM, Donaire A, et Validation of an automatic dose injection system for Ictal SPECT in epilepsy. J Nucl Med. 2012; 53: 324-9.
- Devous MD , Thisted RA, Morgan GF, Leroy RF, Rowe CC. SPECT brain imaging in epilepsy: a meta-analysis. J Nucl Med. 1998; 39: 285-93.
- O’Brien TJ, So EL, Mullan BP, Hauser MF, Brinkmann BH, Jack CR, et Subtraction SPECT co-registered to MRI improves postictal SPECT localization of seizure foci. Neurology. 1999; 52: 137-46.
- Casse R, Rowe CC, Newton M, Berlangieri SU, Scott Positron emission tomography and epilepsy. Mol Imaging Biol. 2002; 4: 338-51.
- Mayoral M, Marti-Fuster B, Carreño M, Carrasco JL, Bargalló N, Donaire A, et al. Seizure-onset zone localization by statistical parametric mapping in visually normal (18) F-FDG PET Epilepsia. 2016; 57: 1236-44.
- Vinton AB, Carne R, Hicks RJ, Desmond PM, Kilpatrick C, Kaye AH, et The extent of resection of FDG-PET hypometabolism relates to outcome of temporal lobectomy. Brain. 2007; 130: 548-60
- Rubi S, Setoain X, Donaire A, Bargallo N, Sanmarti F, Carreño M, et al. Validation of FDG-PET/MRI coregistration in nonlesional refractory childhood epilepsy. 2011; 52: 2216-24.