LABORATORIO
En el estudio del paciente con epilepsia es fundamental descartar alteraciones analíticas que puedan ser el origen de las crisis. Esto adquiere mayor importancia en el caso de pacientes neonatos y en los ancianos. En estas poblaciones son más frecuentes las crisis en relación con alteraciones metabólicas que deben detectarse porque en muchas ocasiones el tratamiento de las mismas resuelve las crisis.
Analítica de sangre
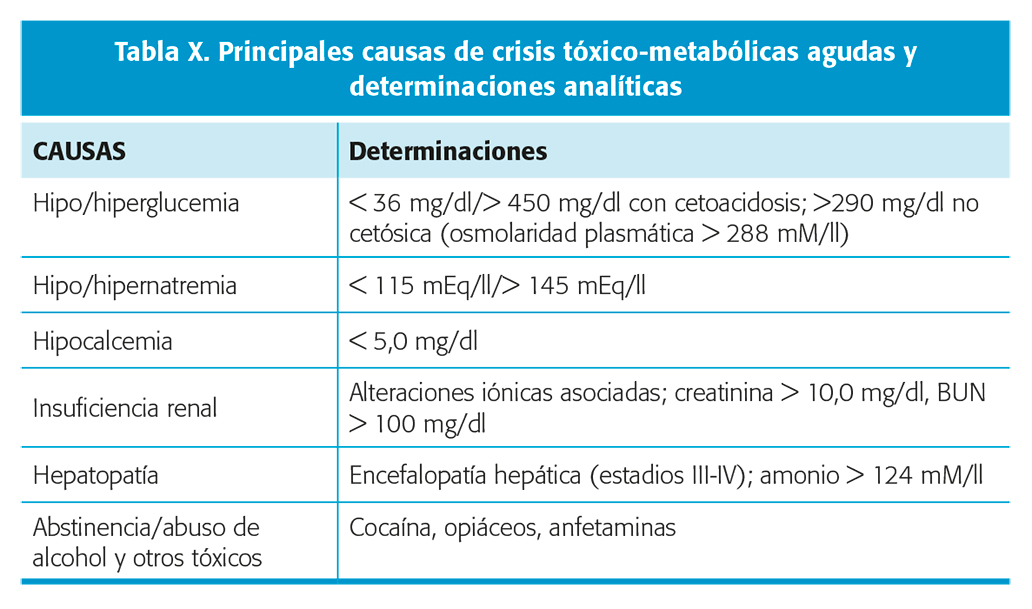
El estudio de laboratorio habitual en los pacientes con una primera crisis debe incluir hemograma, electrólitos (sodio, potasio, calcio, cloro, magnesio, bicarbonato), glucemia, perfil hepático, estudio tiroideo y estudio de la función renal. Nivel de evidencia III18,19En casos de diagnóstico de crisis en Urgencias suele ser útil también la determinación de proteínas, CK, lactato, PCR, VSG o gasometría; y en casos determinados también estudio toxicológico, vitaminas o parathormona (alteraciones del calcio).
Es importante detectar cualquier causa toxicometabólica (tabla X) de crisis, puesto que la corrección de la misma suele ser el tratamiento de las crisis20. Determinaciones también en orina en caso necesario. Las alteraciones de la función tiroidea (sobre todo el hipertiroidismo) y respiratoria también pueden ser causa de crisis que se resuelven con la normalización de la función. En el periodo neonatal, aparte de otros estudios metabólicos más específicos para determinados síndromes como puede ser el análisis de aminoácidos en sangre y orina, es importante considerar el déficit de piridoxina y biotina, que precisan tratamiento de sustitución para la resolución de las crisis.
LCR
El estudio del LCR en el paciente que presenta crisis se debe realizar cuando existe sospecha de infección del SNC o hemorragia subaracnoidea con neuroimagen negativa. También puede ser de utilidad en pacientes inmunocomprometidos y en sospecha de etiología autoinmune o desconocida. Ningún estudio ha examinado el uso sistemático de la punción lumbar en pacientes con crisis de debut19.
Laboratorio y enfermedades autoinmunes
Algunas epilepsias y crisis se pueden asociar a patología inmunológica y ante la sospecha, se debe realizar examen serológico específico (tabla XI).
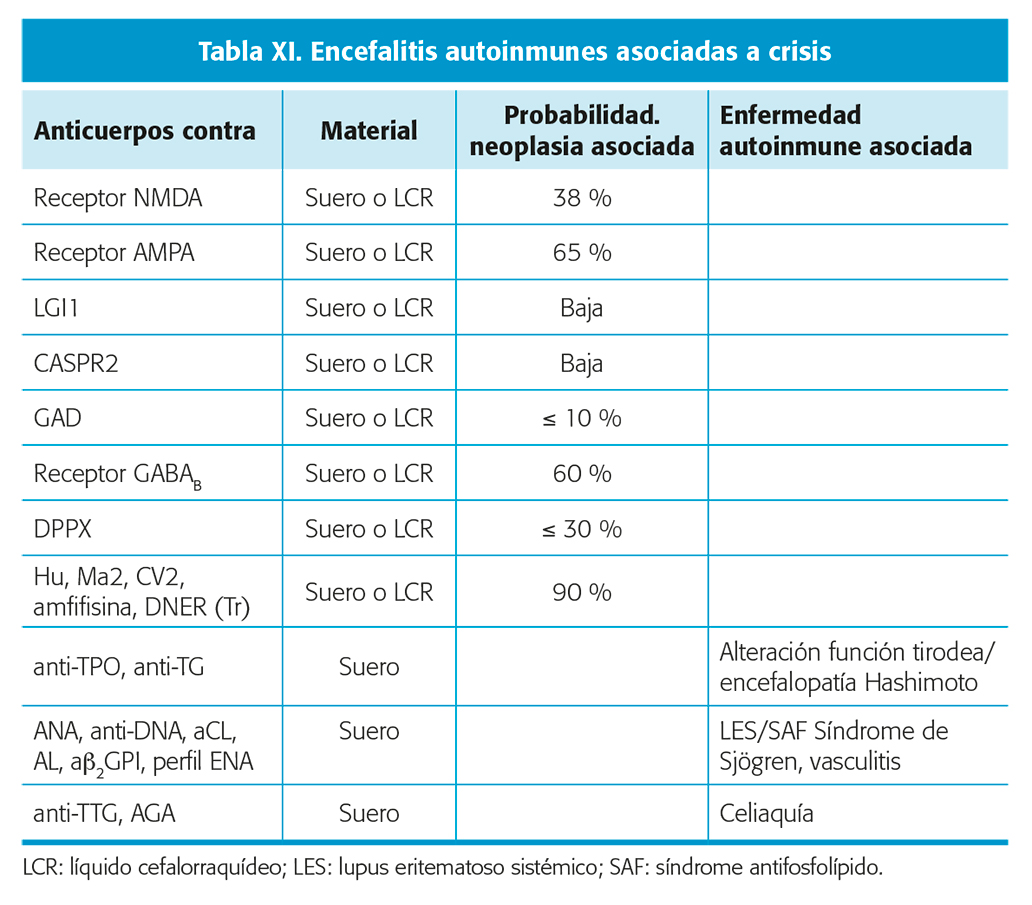
Ante sospecha de encefalitis autoinmune se determinarán los anticuerpos más frecuentes asociados a crisis.
- Estudio inmunológico básico/suero: anti-GAD (glutamic acid decarboxyla sa isoforma 65 kD (GAD-65)), anti-NMDA (N-methyl-D-aspartate), anti-GABA-B, anti-LGI1 (leucine-rich glioma inactivated 1 protein), antitiroperoxidasa (anti-TPO) y antitiroglobulina (anti-TG); y también: anti-AMPA (a-Amino-3-hydroxy-5-methyl-4-isoxazole-propionic acid), anticuerpos contra receptores de glicina, anti-GABA-A, anti-CASPR-2 (contactin-associated protein-2) o dipeptidyl-peptidase-like protein- 6 (DPPX). Si la sospecha es de encefalitis paraneoplásica: anticuerpos onconeuronales (Hu, Ma2, DNER (Tr), CV2, amfifisina). [21,22] No menos importante en caso de sospecha de crisis asociada a enfermedad autoinmune son los anticuerpos relacionados también con patología sistémica que pueden ocasionar crisis como: antinucleares (ANA) clase IgG, anti-ADN, anticardiolipina (aCL), anticuerpos anti-b2-glicoproteína I (ab2GPI), anticoagulante lúpico (AL), antitejido transglutaminasa (anti-TTG), antiendomisio, antigliadina (AGA), ENA (anti-Ro, anti-La, anti-RNP, anti-SM).
- Estudio inmunológico básico/LCR: bioquímica; células; BOC; IgG; albúmina; cuando sea posible: anti-GAD; anti-AMPA; anti-GABA; anti-NMDA; anti-LGI1; anticuerpos onconeuronales (Hu, Ma2, CV2, DNER, amfifisina).
En caso de sospecha de una enfermedad mitocondrial, se deben solicitar también ácido láctico y pirúvico.
ESTUDIOS NEUROPSICOLÓGICOS
Las alteraciones cognitivas se asocian con frecuencia a la epilepsia y/o a su tratamiento, por lo que la evaluación neuropsicológica es necesaria en el diagnóstico y valoración global del paciente con epilepsia23. Debido a la mejoría en las técnicas diagnósticas de neuroimagen y electroencefalografía, el papel fundamental de los test neuropsicológicos radica cada vez más en la monitorización de los efectos de la epilepsia o en la decisión y control de calidad del tratamiento, siendo un requisito fundamental en la evaluación previa y posterior a cirugía de la epilepsia. Aunque siguen siendo útiles como herramientas de apoyo en la detección, lateralización y localización de las disfunciones cerebrales, así como los comportamientos asociados24,25. Los perfiles cognitivos en epilepsia son tan heterogéneos como los síndromes epilépticos en sí mismos; el efecto sobre la cognición puede ser debido a la etiología, topografía del área epileptógena, mecanismos patogénicos, a las diferentes características de la evolución clínica o a la combinación de varios de estos factores. La concienciación de estos problemas facilita la educación, la integración social y el empleo en los pacientes con epilepsia. Nivel de evidencia IV.
Los test neuropsicológicos deben realizarse en cualquier edad para evaluar alteraciones cognitivas en particular en las áreas del lenguaje y de la memoria, y están especialmente indicados. Nivel de evidencia IV23.
- En niños o adultos con dificultades educacionales o laborales.
- Cuando la resonancia magnética (RM) identifica anomalías en regiones cerebrales importantes desde el punto de vista cognitivo.
- Cuando un niño o un adulto aqueja problemas de memoria u otros déficits o declives cognitivos.
Para la selección de los test neuropsicológicos, en general se realiza una aproximación inicial con una batería de test estándar y en caso de que se considere necesaria una aproximación individualizada al paciente o más exhaustiva se seleccionarían test específicos para cada caso. La batería de test estándar utilizada en los diferentes centros es cada vez menos heterogénea, ya que existe cierto acuerdo sobre que dominios a evaluar y cada vez existen más guías de recomendaciones, aunque siguen siendo inevitables las diferencias regionales y la necesidad de tener en cuenta los factores lingüísticos y culturales25.
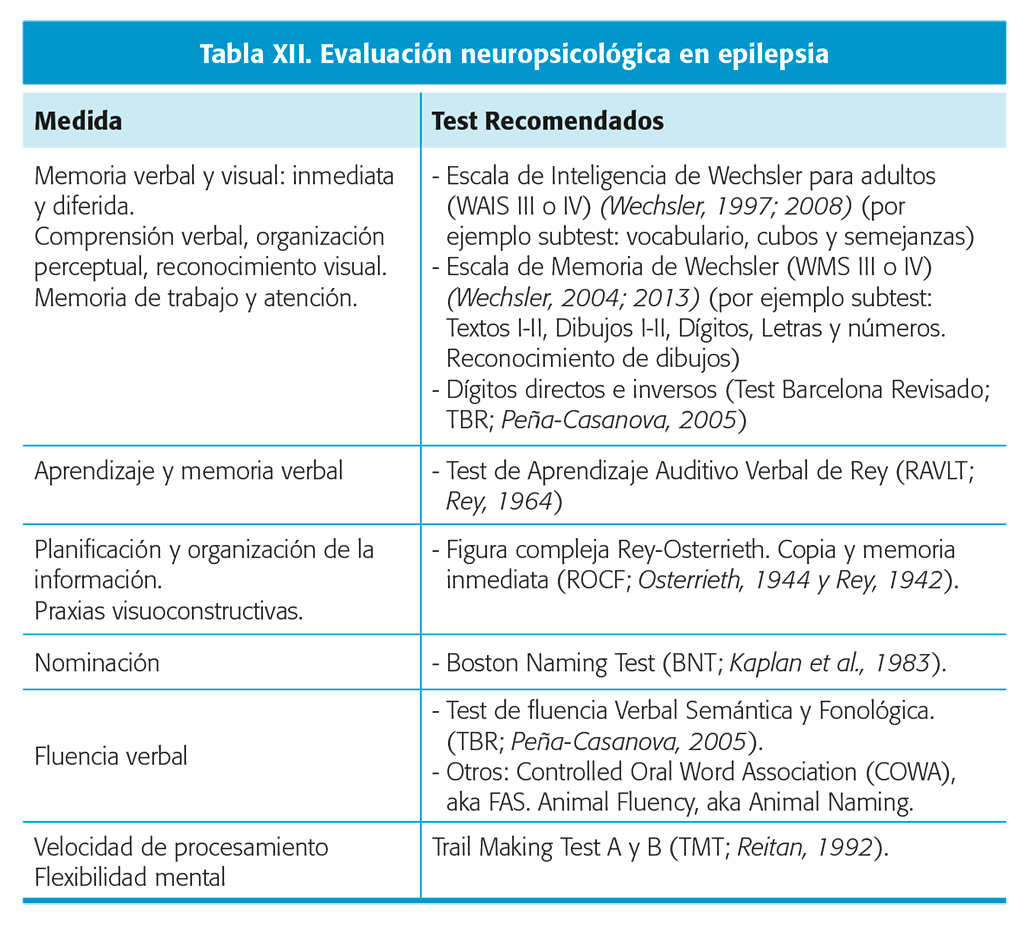
La mayoría de los centros utilizan una batería de test que valoran diferentes dominios cognitivos con intención de capturar las áreas más relevantes afectadas en los diferentes síndromes epilépticos (tabla XII). En general, se incluyen test de inteligencia (CI) para caracterizar el nivel de habilidades cognitivas generales, medidas de aprendizaje y memoria verbal y no verbal, test de lenguaje que incluyen habilidades de nominación y fluencia verbal (semántica y fonológica), medidas de la percepción y razonamiento visuoespacial, velocidad de procesamiento y funciones ejecutivas con evaluación de procesos cognitivos diversos como la atención, flexibilidad mental, memoria de trabajo o planificación25,26.
ESTUDIOS GENÉTICOS
El reciente desarrollo de nuevas técnicas de genética molecular ha contribuido al creciente conocimiento de un significativo número de genes implicados en la etiología de diversos tipos de epilepsia y a la identificación de nuevos síndromes epilépticos.
Las ventajas generales de un estudio genético en epilepsia incluyen la confirmación diagnóstica, la posibilidad de establecer un pronóstico y consejo genético y, en algunos casos concretos, contribuir al manejo terapéutico.
Indicación de estudio genético
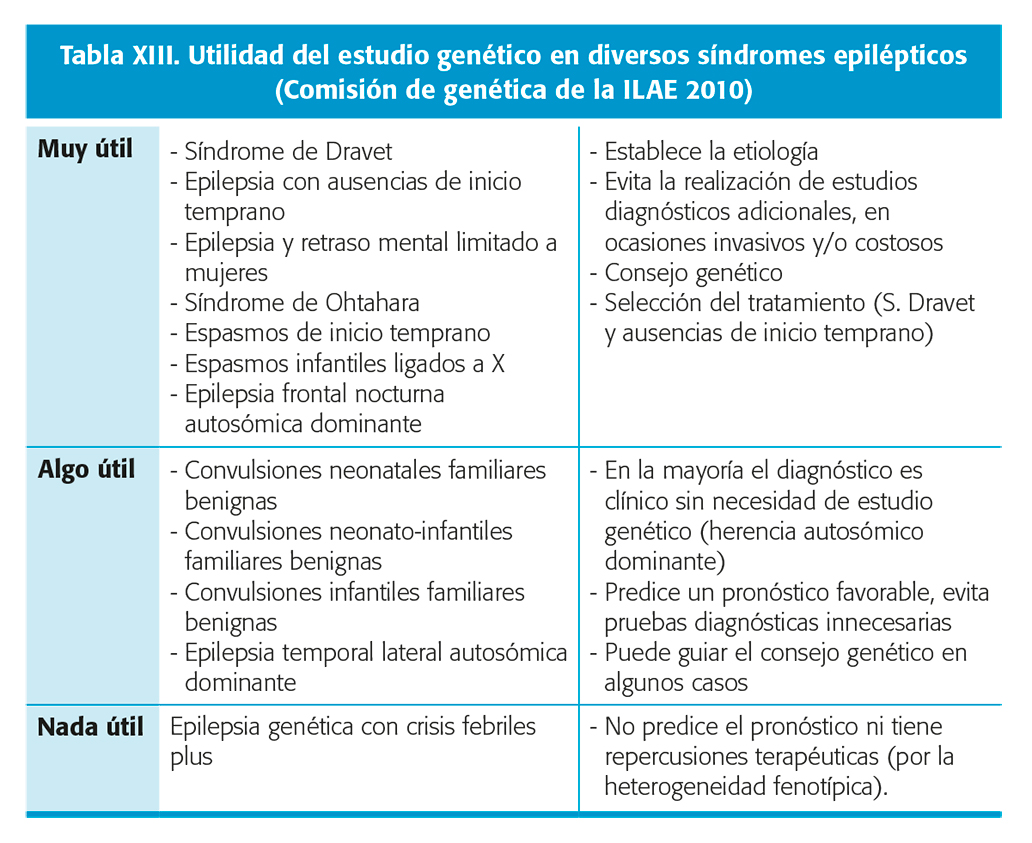
No existen indicaciones sobre la realización sistemática de estudios genéticos. Ante la sospecha de una etiología genética la indicación de realizar un test diagnóstico vendrá determinada por las aplicaciones y/o repercusiones prácticas que se deriven de sus resultados. Dicha utilidad será variable según el tipo de epilepsia o síndrome epiléptico. En el año 2010, la comisión de genética de la ILAE publicó unas recomendaciones referentes a la utilidad de realizar un estudio genético en diversas epilepsias y síndromes epilépticos de base genética basándose en los conocimientos vigentes entonces (tabla XIII). Aunque todavía vigentes, dada la posterior descripción de nuevos genes y la ampliación del espectro clínico asociado a muchos de ellos, en la actualidad dichas recomendaciones resultan incompletas.Nivel de evidencia IV27.
En la práctica clínica, la indicación de un test genético se centra en el estudio de epilepsias monogénicas cuya base genética está claramente establecida. Actualmente resulta indudable la utilidad de estudio genético en epilepsias graves como las epilepsias mioclónicas progresivas y las encefalopatías epilépticas (fundamentalmente en las de inicio en los primeros 2 años de vida) o síndromes epilépticos refractarios de la infancia asociados o no a malformaciones del desarrollo cortical28. La confirmación de un defecto genético en este grupo de epilepsias, especialmente en fases tempranas de la enfermedad, resulta especialmente útil a la hora de confirmar el diagnóstico, evitar la realización de pruebas innecesarias y establecer un pronóstico. Nivel de evidencia IV.
En casos concretos puede ser además útil para seleccionar tratamientos específicos (por ejemplo: dieta cetogénica en pacientes con mutaciones en el gen SLC2A1).
La disponibilidad de un estudio genético no implica necesariamente que resulte útil ni indicado en la práctica clínica habitual. En los síndromes familiares con herencia autosómica dominante (epilepsia temporal lateral familiar, epilepsia generalizada con crisis febriles plus, epilepsia frontal nocturna familiar y epilepsia focal familiar con foco variable) la utilidad práctica del estudio genético es cuestionable al ser el diagnóstico clínico y el pronóstico generalmente benigno. Adicionalmente, en este grupo de epilepsias, la determinación del defecto genético no suele tener implicaciones terapéuticas ni suele contribuir al consejo genético ya que factores como la penetrancia reducida o la expresividad variable contribuyen a no poder predecir el fenotipo de la descendencia.
Selección del test genético
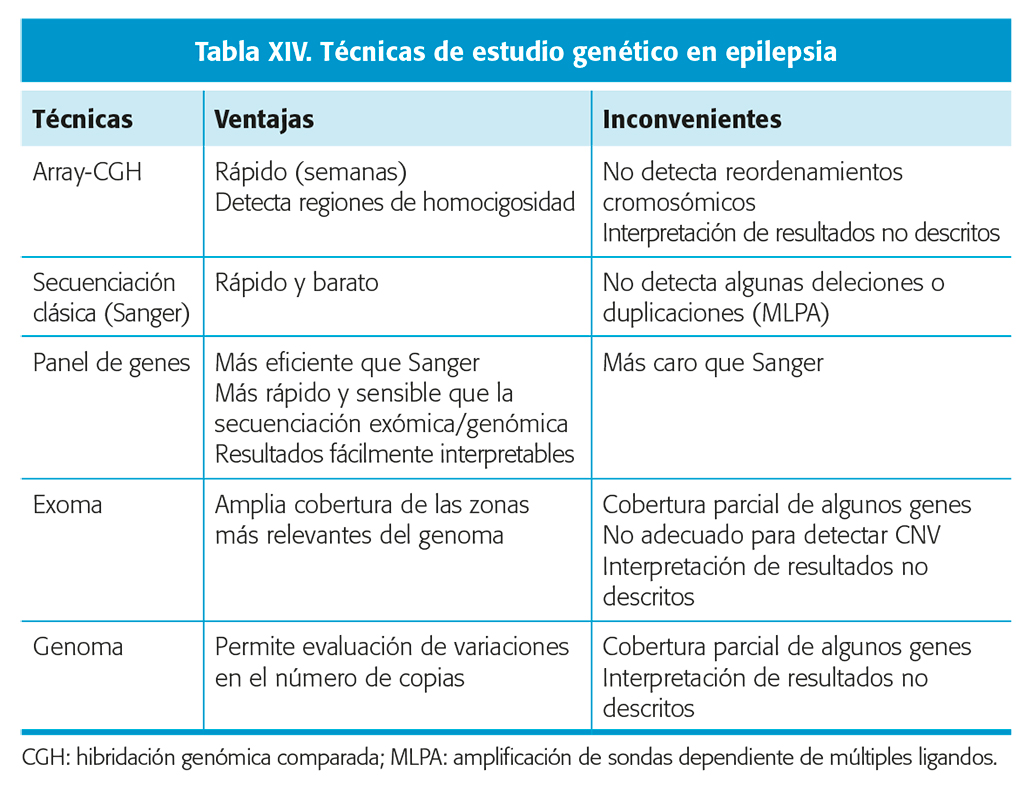
Existen numerosas y diversas técnicas de estudio genético (tabla XIV) si bien no existe un algoritmo que guíe la selección del tipo de estudio a realizar. En ocasiones puede ser necesario la realización secuencial de dos o más técnicas. La selección del tipo de estudio, o estudios, variará en función del tipo de alteración genética que se pretenda detectar y la heterogeneidad genética del fenotipo sujeto a estudio:
- Estudio de array-CGH (hibridación genómica comparada): Indicado cuando se sospecha una alteración cromosómica, ya sea por presentar un síndrome conocido de duplicación o microdeleción o bien en cualquier paciente con epilepsia y retraso, trastorno generalizado del desarrollo y/o dismorfias, la técnica de elección es un array-CGH. La rentabilidad diagnóstica de esta técnica supera claramente a la del cariotipo convencional cuya indicación en epilepsia ha quedado prácticamente relegada al estudio del cromosoma 20 en anillo29. Nivel de evidencia IV.
- Secuenciación de gen candidato (Sanger): adecuado cuando el fenotipo clínico del paciente se ha asociado a mutaciones en uno o dos genes. Un ejemplo sería la secuenciación del gen SCN1A en el síndrome de Dravet (se encuentran mutaciones patogénicas en el 80-90 % de los pacientes). Si el resultado es negativo debe complementarse con otras técnicas como el estudio de deleciones subteloméricas-MLPA (amplificación de sondas dependiente de ligando múltiples) ya que algunas deleciones o duplicaciones pueden no ser detectadas mediante secuenciación clásica.
- Panel genético: adecuado para el estudio de síndromes asociados a varios genes, como ocurre con la mayoría de las encefalopatías epilépticas de inicio precoz. Con esta técnica se restringe el análisis a un grupo de genes previamente relacionados con síndromes epilépticos, ganando en sensibilidad y facilitando la interpretación de resultados. En algunos centros se realiza un exoma clínico centrándose únicamente en el estudio de genes que se han visto involucrados en alguna patología.
- Secuenciación exómica o genómica: valorable cuando el fenotipo clínico del paciente no se ha relacionado previamente con una alteración genética o bien el resultado del panel genético es negativo. Este tipo de abordaje aumenta el riesgo de detectar alteraciones en genes que no se hayan vinculado previamente con epilepsia o con el fenotipo del paciente resultando difícil determinar su relación causal con la enfermedad.

Bibliografía
- Beghi E, Carpio A, Forsgren L, Hesdorffer DC, Malmgren K, Sander JW, et al. Recommendation for a definition of acute symptomatic Epilepsia. 2010; 51: 671-5.
- Gavvala JR, Schuele SU. New onset seizures in adults and adolsecents: a review. 2018; 316(24): 2657-68.
- Beghi E, De Maria G, Gobbi G, Veneselli E. Diagnosis and treatment of the first epileptic seizure: guidelines of the Italian League against Epilepsy. 2006; 47(Suppl 5):2-8.
- Britton Autoimmune epilepsy. Handb Clin Neurol. 2016; 133: 219-45.
- Bien CG. Diagnosing autoimmune encephalitis based on clinical features and autoantibody Expert Rev Clin Immunol. 2019; 15(5): 511-27.
- National Institute for Health and Clinical Excellence (NICE) NICE clinical guideline. The epilepsies: the diagnosis and management of the epilepsies in adults and children in primary and secondary care. London. 2012, updated 2018. www.nice.org.uk NICE 2019
- Helmstaedter C, Witt JA. Clinical neuropsychology in epilepsy: theoretical and practical Handb Clin Neurol. 2012; 107: 437-59. doi: 10.1016/B978-0-444-52898-8.00036-7.
- Wilson SJ, Baxendale S, Barr W, Hamed S, Langfitt J, Samson S, et al. Indications and expectations for neuropsychological assessment in routine epilepsy care: report of the ILAE Neuropsychology Task Force, Diagnostic Methods Comission, 2013-2017. 2015; 56(5): 674-81.
- Jones-Gotman M, Smith ML, Risse GL, Westerveld M, Swanson SJ, Giovagnoli AR, et The contribution of neuropsychology to diagnostic assessment in epilepsy. Epilepsy Behav. 2010; 18(1-2): 3-12.
- Ottman R, Hirose S, Jain S, Lerche H, Lopes-Cendes I, Noebels JL, et Genetic testing in the epilepsies—Report of the ILAE Genetics Commission. Epilepsia. 2010; 51: 655-70.
- Moller R, Dahl Helbig I. The contribution of next generation sequencing to epilepsy genetics. Exp Rev Mol Diagnostics. 2015; 15(12): 1531-8.
- Miller DT, Adam MP, Aradhya S, Biesecker LG, Brothman AR, Carter NP, et Consensus statement: chromosomal microarray is a first-tier clinical diagnostic test for individuals with developmental disabilities or congenital anomalies. Am J Hum Genet. 2010; 86: 749-64.

